CJC1295 DAC ist ein synthetisches Wachstumshormon-freisetzendes Hormon (GHRH)-Analog, das zur Wachstumshormon-Prosekretionspeptidklasse gehört. Es ist darauf ausgelegt, die Funktion des endogenen GHRH nachzuahmen und die Freisetzung von Wachstumshormon (GH) aus der Hypophyse zu stimulieren, was indirekt die Synthese des insulinähnlichen Wachstumsfaktor-1 (IGF-1) fördert und anschließend die physiologischen Prozesse wie Proteinsynthese, Lipidstoffwechsel und Zellreparatur reguliert. Im Gegensatz zu gewöhnlichen GHRH-Analoga wird CJC-1295 DAC strukturell mit der Drug Affinity Complex (DAC)-Technologie modifiziert, die seine Halbwertszeit (bis zu 6–8 Tage) erheblich verlängert und die Häufigkeit der Verabreichung verringert.
Was ist CJC 1295 DAC?
CJC1295 DAC ist im Wesentlichen ein auf 30 Aminosäuren basierendes Peptid.237 Es ist ein langwirksames Analogon des Wachstumshormonfreisetzungshormons (GHRH) mit spezifischen strukturellen Modifikationen, die im Vergleich zu traditionellem GHRH einzigartige pharmakokinetische Eigenschaften verleihen. CJC1295 DAC enthält eine funktionelle Maleimidopropionsäure-Gruppe am C-Terminus, ein strukturelles Merkmal, das es ihm ermöglicht, kovalent an freie Thiole auf der Oberfläche von Plasmaproteinen zu verknüpfen und so ein CJC1295-Protein-Affix zu bilden. CJC1295 DAC enthält eine funktionelle Malamidonpropionsäuregruppe am C-terminalen Ende, ein strukturelles Merkmal, das es ermöglicht, kovalent mit freien Thiolen auf der Oberfläche von Plasmaproteinen zu verbinden, um CJC1295-Protein-Affixe zu bilden und so den Stoffwechsel und die Wirkungsdauer des Medikaments im Körper zu verändern.
CJC1295-ADC-Struktur
CJC1295-DAC-Forschung
Fördert die Synthese und Sekretion von Wachstumshormonen
CJC - 1295 – DAC bindet speziell an den GHRH-Rezeptor auf der Oberfläche von Wachstumshormonzellen in der vorderen Hypophyse und aktiviert eine Reihe intrazellulärer Signalwege, wie den cAMP-Protein-Kinase-A-Signalweg und den Phospholipase-C-Protein-Kinase-C-Signalweg. Die Aktivierung dieser Signalwege fördert letztlich die Transkription und Translation des Wachstumshormongens, was zu einer Steigerung der Wachstumshormonsynthese führt. Gleichzeitig fördert CJC - 1295 - DAC auch die Freisetzung gespeicherten Wachstumshormons in den Kreislauf, wodurch der Wachstumshormonspiegel im Blut steigt.
Es wurde gezeigt, dass die Verabreichung von CJC - 1295 - DAC zu einer dosisabhängigen Erhöhung der Wachstumshormonspiegel bei Versuchstieren oder Patienten führt. Nach einer einzigen Injektion von CJC - 1295 - DAC können die Wachstumshormonkonzentrationen im Plasma innerhalb weniger Tage um ein Vielfaches ansteigen, und dieser Anstieg kann über einen längeren Zeitraum gehalten werden. So führte beispielsweise in einer Studie mit gesunden Probanden eine einzige Injektion von CJC-1295-DAC zu einer 2- bis 10-fachen Erhöhung der mittleren Plasmawachstumshormonkonzentrationen über einen Zeitraum von 6 Tagen oder mehr sowie zu einer 1,5- bis 3-fachen Erhöhung der mittleren insulinähnlichen Plasma-Faktor-I-Konzentrationen über einen Zeitraum von 9 bis 11 Tagen [2].
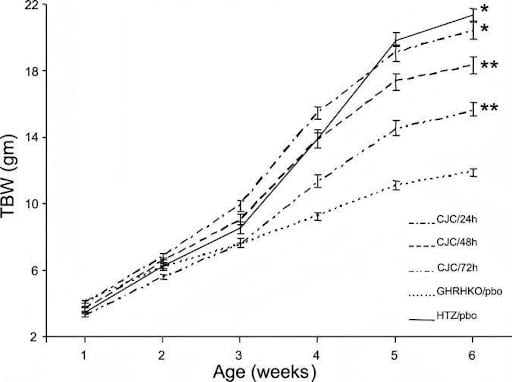
Abb. 1. Wirkung von CJC-1295 auf das Gesamtkörpergewicht (TBW; bedeutet ± SE). Am Ende der 5-wöchigen Behandlungsphase zeigte die CJC/24-Stunden-Gruppe völlig normale TBW. Die Gruppen CJC/48 h und CJC/72 h erreichten im Vergleich zur GHRHKO/pbo-Gruppe eine signifikant höhere TBW, obwohl sie kleiner blieb als in der HTZ/pbo-Gruppe. Siehe Materialien und Methoden für Gruppendetails. CJC, CJC-1295-Behandlung; GHRHKO, Wachstumshormon (GH)-freisetzendes Hormon (GHRH) Knockout; HTZ, heterozygot; PBO, Placebo. *P < 0,01 gegen CJC/48 H, CJC/72 H und GHRHKO/pbo. **P < 0,001 vs. GHRHKO/pbo.
Quelle: PubMed [2]
Reguliert die Proliferation und Differenzierung von Wachstumshormonzellen
CJC-1295-DAC fördert die Synthese und Sekretion von Wachstumshormonen und reguliert zudem die Proliferation und Differenzierung von Wachstumshormonzellen in der vorderen Hypophyse. CJC-1295-DAC aktiviert relevante Signalwege, und diese Aktivierung fördert die Mitose von Wachstumshormonzellen, was zu einer Zunahme der Anzahl der Wachstumshormonzellen führt. Darüber hinaus fördert es auch die Differenzierung undifferenzierter Zellen zu Wachstumshormonzellen, wodurch die Wachstumshormonzellpopulation weiter wachsen kann (Alba M, 2006). Die Forscher führten Tierstudien an GHRH-Knockout-Mäusen durch, auch bekannt als GHRHKO-Mäuse, die mit CJC-1295-DAC behandelt wurden, einem Tiermodell, das Wachstumshormonmangel nachahmt. Die Studie ergab, dass CJC-1295-DAC die gesamten Hypophysen-RNA- und GH-mRNA-Spiegel erhöhte, was auf eine Zunahme der Anzahl der Wachstumshormonzellen hindeutet. Immunhistochemische Bilder zeigten ebenfalls eine Zunahme der Anzahl von Wachstumshormonzellen. Dies zeigt, dass CJC-1295-DAC die Sekretion von Wachstumshormon radikal erhöht, indem es die Proliferation und Differenzierung von Wachstumshormonzellen reguliert [2].
Wachstumshormon hat eine Reihe physiologischer Effekte im Körper, von denen die offensichtlichsten das Wachstum und die Entwicklung betreffen; CJC - 1295 - DAC erhöht den Wachstumshormonspiegel und fördert dadurch das Knochenwachstum, erhöht die Muskelmasse und reduziert die Fettansammlung, was wiederum die wachstumsbezogenen Marker bei Patienten mit Wachstumshormonmangel verbessert. Beim Knochenwachstum stimuliert das Wachstumshormon die Produktion von IGF-I in Geweben wie der Leber, das direkt auf die Wachstumsplatte des Knochens wirkt, um die Proliferation und Differenzierung der Chondrozyten zu fördern und so das längsgående Knochenwachstum zu fördern. Bei GHRHKO-Mäusen, die mit CJC-1295-DAC behandelt wurden, erreichten die täglichen Mäuse normales Körpergewicht und -länge, alle 48 und 72 Stunden behandelte Mäuse hatten ein höheres Körpergewicht und höhere Länge als die Placebo-Gruppe, und die Oberschenkel- und Schienbeinlänge blieben bei Mäusen alle 24 und 48 Stunden normal, was darauf hindeutet, dass CJC-1295-DAC wirksam das Knochenwachstum fördert (CJC-1295-DAC). DAC ist wirksam bei der Förderung des Knochenwachstums[1].
Verbesserung wachstumsbezogener Indikatoren
Wachstumshormon hat im Körper eine Reihe physiologischer Rollen, wobei die ausgeprägtsten Auswirkungen auf Wachstum und Entwicklung sind. CJC - 1295 - DAC erhöht den Wachstumshormonspiegel, was wiederum das Knochenwachstum fördert, die Muskelmasse erhöht und die Fettansammlung reduziert, was wiederum die wachstumsbezogenen Marker bei Patienten mit Wachstumshormonmangel verbessert. Beim Knochenwachstum stimuliert das Wachstumshormon die Produktion von IGF-I in Geweben wie der Leber, das direkt auf die Wachstumsplatte des Knochens wirkt, um die Proliferation und Differenzierung der Chondrozyten zu fördern und so das längsgående Knochenwachstum zu fördern. Bei GHRHKO-Mäusen, die mit CJC-1295-DAC behandelt wurden, erreichten Mäuse mit der Tagesdosis normales Körpergewicht und -länge, Mäuse alle 48 und 72 Stunden ein höheres Körpergewicht und -längen als die Placebo-Gruppe, und alle 24 und 48 Stunden behandelten Mäuse normale Oberschenkel- und Schienbeinlängen, was darauf hindeutet, dass CJC-1295-DAC wirksam das Knochenwachstum fördert (CJC-1295-DAC). DAC ist wirksam bei der Förderung des Knochenwachstums [1].
CJC - 1295 - DAC-Behandlung von Muskelatrophie
Reguliert den Proteinstoffwechsel
Fördert die Proteinsynthese: CJC-1295-DAC stimuliert die Freisetzung von Wachstumshormon, das den insulinähnlichen Wachstumsfaktor-1 (IGF-1)-Signalweg aktiviert, einen Schlüsselfaktor zur Regulierung des Muskelwachstums und -reparaturs, der die Ribosomenbiosynthese und die Proteintranslationsinitiierung über die PI3K-Akt-mTOR-Signalachse fördert und so die Muskelproteinsynthese erhöht. Sie fördert die ribosomale Biosynthese und die Proteintranslationsinitiierung über die PI3K-Akt-mTOR-Signalachse und erhöht so die Muskelproteinsynthese. Im Fall des Akt-Proteins zum Beispiel phosphoryliert und hemmt es beim Aktivieren den tuberösen Sklerosekomplex 2 (TSC2), der mTOR aktiviert. mTOR reguliert weiter nachgeschaltete Effektormoleküle wie p70S6K und 4E-BP1, um die Expression von Genen zu fördern, die an der Proteinsynthese beteiligt sind, wodurch letztlich die Menge an Muskelproteinen erhöht wird, was helfen kann, Muskelatrophie entgegenzuwirken [3].
Hemmung des Proteinabbaus: Proteinabbauwege werden oft während der Muskelatrophie aktiviert, und CJC - 1295 - DAC kann den Abbau von Muskelproteinen reduzieren, indem es das Ubiquitin-Proteasom-System (UPS) und die Autophagie-Lysosomen-Signalwege hemmt. Im UPS-Weg führt eine erhöhte Expression muskelspezifischer E3-Ubiquitin-Ligasen wie MuRF1 und Atrogin-1 zu Ubiquitinierung und Abbau von Muskelproteinen. Es wird vermutet, dass CJC - 1295 - DAC den Proteinabbau hemmen kann, indem es die relevanten Signalwege moduliert und die Expression von MuRF1 und Atrogon-1 senkt. Im Autophagie-Lysosomen-Weg kann CJC - 1295 - DAC die Expression autophagiebezogener Gene oder die Bildung von Autophagosomen beeinflussen und den Abbau von Muskelproteinen durch den Autophagieweg reduzieren, um die Homöostase des Muskelproteins aufrechtzuerhalten [4].
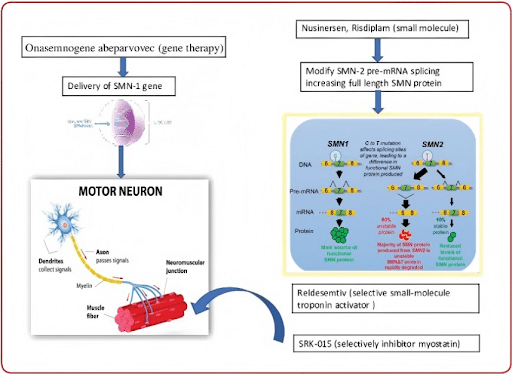
Abb. 2: Zentrale bestehende therapeutische Optionen und deren Wirkmechanismus SMN1 = Überlebensmotorneuron 1; SMN2 = Überlebensmotorneuron 2; SMN = Überlebensmotorneuron
Quelle: PubMed[4]
Förderung der Vermehrung und Differenzierung von Satellitenzellen: Satellitenzellen sind myogene Stammzellen in der Skelettmuskulatur, die eine wichtige Rolle bei der Reparatur und dem Wachstum von Muskelverletzungen spielen. CJC - 1295 - DAC kann die Proliferation und Differenzierung von Satellitenzellen über die Wachstumshormon-IGF-1-Achse fördern. IGF-1 kann die Satellitenzellen aus dem Ruhezustand in den Zellzyklus anregen und so die Anzahl der Satellitenzellen erhöhen. IGF-1 reguliert außerdem die Expression myogener Regulatoren (z. B. MyoD, Myf5 und Myogenin usw.), was die Differenzierung von Satellitenzellen zu Myoröhren fördert, wo sie fusionieren, um neue Myofasern zu bilden oder beschädigte Myofasern zu reparieren, was zur Wiederherstellung und Steigerung der Muskelmasse sowie zur Verbesserung der Muskeldystrophie beiträgt [3].
Verbesserung des Muskelenergie-Stoffwechsels: Der Energiestoffwechsel wird bei Muskelatrophie meist gestört, und CJC - 1295 - DAC kann den Energiestoffwechsel der Muskeln positiv beeinflussen, indem er den Wachstumshormonspiegel reguliert. Wachstumshormon kann die Lipolyse fördern und die oxidative Energieversorgung mit Fettsäuren erhöhen, wodurch mehr Energiesubstrate für die Muskeln bereitgestellt werden. Gleichzeitig kann Wachstumshormon auch die mitochondriale Funktion in Muskelzellen regulieren, die mitochondriale Biosynthese und -aktivität erhöhen und die oxidative Phosphorylierungskapazität der Muskelzellen verbessern, sodass die Muskeln Energie effizienter nutzen und die normale Muskelfunktion und -wachstum erhalten können. So wurde beispielsweise in einigen Experimenten mit CJC - 1295 - DAC eine Zunahme der Mitochondrien- und Atemkettenkomplexaktivität im Muskelgewebe beobachtet, was darauf hindeutet, dass dies einen mildernden Einfluss auf den Muskelenergiestoffwechsel hat [3].
Modulation der Entzündungsreaktion: Entzündungen spielen eine wichtige Rolle bei der Entstehung vieler Muskeldystrophien, und CJC - 1295 - DAC kann indirekt die Expression und Freisetzung von Entzündungsfaktoren beeinflussen, indem sie die Freisetzung von Wachstumshormon moduliert. Wachstumshormon hat einige entzündungshemmende Effekte, da es die Produktion proinflammatorischer Zytokine (z. B. TNF - α, IL - 1β und IL - 6 usw.) hemmt und gleichzeitig die Expression entzündungshemmender Zytokine (z. B. IL - 10 usw.) fördert. Die Verringerung der Entzündungsreaktion hilft, die Entzündungsschäden am Muskelgewebe zu verringern und eine günstige Mikroumgebung für Muskelreparatur und -wachstum zu schaffen, wodurch das Fortschreiten der Muskelatrophie bis zu einem gewissen Grad gemildert wird [3].
CJC - 1295 - DAC-Behandlung der Osteoporose
Fördert die Osteoblastenaktivität
CJC-1295 – DAC regt die Hypophyse zur Ausschüttung von Wachstumshormon an, das wiederum die zirkulierenden Wachstumshormonspiegel erhöht. Wachstumshormon wirkt direkt auf Osteoblasten, um deren Vermehrung und Differenzierung zu fördern. Es wurde gezeigt, dass Wachstumshormon die Expression spezifischer Gene in Osteoblasten wie Runx2 (Kernbindungsfaktor α1) erhöht, das eine Schlüsselrolle bei der Regulierung der Differenzierung von Osteoblasten und der Knochenbildung spielt. runx2 reguliert die Expression einer Reihe von nachgelagerten Genen, die zur Reifung von Osteoblasten beitragen können, und fördert außerdem die Synthese von Knochenmatrizen wie Kollagen I. Die Synthese von Substanzen wie Osteocalcin und Osteoblasten wird ebenfalls durch die Synthese von Wachstumshormonen, Osteocalcin und anderen Substanzen gefördert [5].
Wachstumshormon bewirkt außerdem, dass die Leber und andere Gewebe IGF-1 produzieren, das auf Osteoblasten autokrin und parakrin wirkt. IGF-1 fördert nicht nur die Osteoblastenproliferation und hemmt die Apoptose von Osteoblasten, sondern verbessert auch die Funktion der Osteoblasten, zum Beispiel durch die Förderung der Synthese von Knochenmatrixproteinen und den Prozess der Mineralisierung. Darüber hinaus kann IGF-1 die PI3K-Akt- und MAPK-Signalwege aktivieren, um das Überleben und die Proliferation von Osteoblasten zu fördern und letztlich die Knochenbildung zu fördern.
Hemmung der Osteoklastaktivität
CJC-1295 – DAC erhöht die Spiegel von Wachstumshormon und IGF-1 und beeinflusst auf diese Weise indirekt das Zytokinnetzwerk, um die Bildung und Aktivität von Osteoklasten zu hemmen. IGF-1 hemmt beispielsweise die Expression des nukleären Faktor-κB-Rezeptor-aktivierenden Faktorligands (RANKL), eines Zytokins, das für die Osteoklastendifferenzierung und -aktivierung unerlässlich ist. Wenn RANKL an seinen Rezeptor RANK bindet, aktiviert es eine Reihe von Signalwege, die Osteoklastenvorläuferzellen dazu bringen, sich zu reifen Osteoklasten zu differenzieren. indem IGF-1 die Expression von RANKL hemmt, reduziert es die Bildung von Osteoklasten, was wiederum das Ausmaß der Knochenresorption verringert.
Osteoprotegerin (OPG), ein lösliches Mitglied der Superfamilie des Tumornekrosefaktor-Rezeptors, hemmt die Osteoklastendifferenzierung und -aktivierung, indem es als Täuschungsrezeptor wirkt, der an RANKL bindet und so die Interaktion von RANKL mit RANKL blockiert. CJC - 1295 - DAC kann durch die Modulation der Wachstumshormon-IGF-1-Achse zur Sekretion von OPG aus Osteoklasten beitragen, wodurch das OPG/RANKL-Verhältnis reduziert werden kann. CJC - 1295 – DAC kann die Osteoklastenaktivität hemmen und die Knochenresorption verringern, indem es die Wachstumshormon-IGF-1-Achse reguliert und Osteoblasten zur Sekretion von OPG induziert, wodurch das OPG/RANKL-Verhältnis erhöht wird.
Verbesserung der Knochenmikrostruktur
Da CJC - 1295 - DAC die Osteoblastenaktivität fördert und die Osteoklastenaktivität hemmt, verschiebt dies das Gleichgewicht von Knochenbildung und -resorption zugunsten der Knochenbildung. Bei Patienten mit Osteoporose ist die trabekuläre Struktur häufig beschädigt, was sich durch Ausdünnung, Fraktur und verminderte Vernetzung der Trabeculae äußert. CJC-1295-DAC hilft, die Konnektivität von Trabeculae zu reparieren und zu verbessern, indem es die Bildung neuer Knochen fördert und die Knochenresorption reduziert, was die Mikrostruktur des Knochens verbessert und somit die Stärke des Knochens verbessert [6].
Neben seinen Auswirkungen auf Trabeculae kann CJC-1295-DAC auch positive Auswirkungen auf den Knochenkortex haben. Wachstumshormon und IGF-1 erhöhen die Aktivität der subperiostealen Osteoblasten, was die Dicke und Dichte des Knochenkortex erhöht. Dies hat wichtige Auswirkungen auf die Verbesserung der gesamten mechanischen Eigenschaften des Skeletts und kann das Risiko von Brüchen bei Patienten mit Osteoporose verringern [6].
CJC - 1295 - DAC bietet als Substanz mit einem einzigartigen Wirkmechanismus und potenziellem Anwendungswert eine breite Forschungsperspektive im Bereich der Biomedizin. Obwohl einige Fortschritte in Basis- und präklinischen Studien erzielt wurden, ist eine weitere eingehende Untersuchung ihrer Sicherheit, Wirksamkeit und optimalen Anwendungsprotokolle erforderlich, damit ihre rationale Anwendung in der klinischen Behandlung und anderen verwandten Bereichen realisiert werden kann.
Artikelautor
Die oben genannte Literatur wurde von Dr. Velira Nyssén recherchiert, redigiert und organisiert.
Autor wissenschaftlicher Zeitschrift
Dr. Gordon S. Lynch ist ein angesehener Forscher, der mit mehreren angesehenen Institutionen verbunden ist, darunter die University of Melbourne, das Walter & Eliza Hall Institute of Medical Research, das Naval Health Research Center (NHRC), die Birkbeck University of London und die University of Birmingham. Mit einem soliden akademischen und wissenschaftlichen Hintergrund erstreckt sich seine Arbeit über vielfältige wissenschaftliche Bereiche und spezialisiert sich auf Physiologie, Zellbiologie, Biochemie & Molekularbiologie, Neurowissenschaften & Neurologie sowie Endokrinologie & Stoffwechsel. Dr. Lynchs interdisziplinärer Ansatz integriert diese Fachgebiete, um kritische Fragen der Grundlagen- und translationalen Forschung zu adressieren und trägt wesentlich zu Fortschritten in den Lebenswissenschaften und der menschlichen Gesundheit bei. Seine Zusammenarbeit mit internationalen Institutionen unterstreicht sein Engagement für die Förderung globaler wissenschaftlicher Partnerschaften und die Förderung von Innovationen in der biomedizinischen Forschung.
Zitate Quellenangaben
[1]. Alba M, Fintini D, Sagazio A, Lawrence B, Castaigne J, Frohman LA, Salvatori R. Die einmal tägliche Verabreichung von CJC-1295, einem langwirksamen, wachstumshormonfreisetzenden Hormon (GHRH)-Analog, normalisiert das Wachstum der GHRH-Knockout-Maus. AM J PHYSIOL-ENDOC M. [Fachartikel]. 2006 2006-12-01; 291(6):E1290-4.10.1152/ajpendo.00201.2006
[2]. Teichman SL, Neale A, Lawrence B, Gagnon C, Castaigne J, Frohman LA. Verlängerte Stimulation von Wachstumshormon (GH) und insulinähnlichem Wachstumsfaktor I durch CJC-1295, ein langwirksames Analogon des GH-freisetzenden Hormons, bei gesunden Erwachsenen. Das Journal of Clinical Endocrinology & Metabolism. 2006 0003-01-03; 91(3):799-805.10.1210/jc.2005-1536
[3]. Lynch GS, Schertzer JD, Ryall JG. Therapeutische Ansätze bei Muskelschwundstörungen. PHARMACOL-THERAPEUT. 2007; 113(3):461-87. https://doi.org/10.1016/j.pharmthera.2006.11.004
[4]. Wu Q, Liang B. Der Mechanismus zur Behandlung denervierter Muskelatrophie mit perkutaner elektrischer Stimulation. Chinesisches Journal für Handchirurgie. 2010; 26:182-4 https://www.sciencedirect.com/science/article/PII/S0163725806001902
[5]. Balasubramanian M, Fratzl-Zelman N, O'Sullivan R, Bull M, Fa Peel N, Pollitt RC, Jones R, Milne E, Smith K, Roschger P, Klaushofer K, Bishop NJ. Neue PLS3-Varianten bei X-chromosengebundener Osteoporose: Erforschung der Eigenschaften des Knochenmaterials. AM J MED GENET A. [Fallberichte; Fachartikel; Forschungsunterstützung, Nicht-US-amerikanische Gov't]. 2018 2018-07-01; 176(7):1578-86.10.1002/ajmg.a.38830
[6]. Wang X, Li H, Long L, Song C, Chen R, Pan H, Qiu J, Liu B, Liu Z. Mechanismus der Liuwei-Dihuang-Pillen bei der Behandlung von Osteoporose basierend auf Netzwerkpharmakologie. MEDIZIN. 2023; 102 https://api.semanticscholar.org/CorpusID:264347668
ALLE ARTIKEL UND PRODUKTINFORMATIONEN AUF DIESER WEBSITE DIENEN AUSSCHLIESSLICH ALS REFERENZ UND ZU BILDUNGSZWECKEN.
Die angebotenen Produkte sind streng für die In-vitro-Forschung vorgesehen (vom Latein: "in Glas"), was sich auf Studien außerhalb lebender Organismen bezieht. Diese Substanzen stellen keine pharmazeutischen Medikamente dar und wurden nicht von der US-amerikanischen Food and Drug Administration (FDA) zur Prävention, Behandlung oder Heilung von medizinischen Erkrankungen, Krankheiten oder Störungen geprüft oder zugelassen. Nach gesetzlichen Bestimmungen ist jegliche Einführung dieser Produkte in menschliche oder tierische biologische Systeme, unabhängig von der Verabreichungsmethode, ausdrücklich verboten.