Das Delta-Schlafinduzierende Peptid (DSIP) ist ein endogenes Neuropeptid, das ursprünglich in der Rückmarksflüssigkeit von Tieren gefunden wurde und nach seiner Fähigkeit benannt wurde, Delta-Gehirnwellen (ein Markenzeichen des langsamen Schlafs) zu induzieren. Seit seiner Isolation im Jahr 1977 hat es umfangreiche Forschung in den Lebenswissenschaften ausgelöst. Als erste Schlafsubstanz, deren chemische Struktur aufgeklärt wurde, ist SIP aufgrund seiner einzigartigen schlaffördernden Wirkung und der geringen toxischen Nebenwirkungen zu einer wichtigen Forschungsrichtung zur Behandlung von Schlaflosigkeit geworden.
Was ist DSIP?
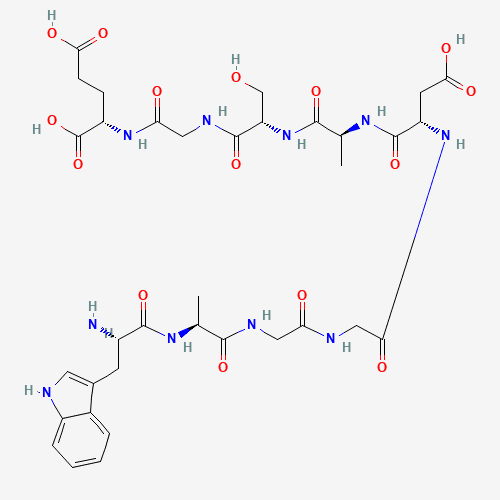
DSIP ist ein Peptid mit einer spezifischen Aminosäuresequenz, bestehend aus 9 Aminosäureresten, die natürlich im Hypothalamus und anderen Hirnregionen von Säugetieren vorkommen, jedoch in extrem niedrigen Mengen. Seine einzigartige Aminosäureanordnung verleiht DSIP besondere biologische Aktivitäten, sodass es verschiedene physiologische Funktionen in Organismen erfüllen kann, insbesondere bei der Schlafregulation.
Die DSIP-Struktur
DSIP-Forschung
DSIP induziert und reguliert den Schlaf
Forscher haben herausgefunden, dass DSIP-CBBBP die Neurotransmitterspiegel von 5-HT, Glutamat, Dopamin und Melatonin bei Mäusen reguliert. In Rattenexperimenten wurde auch beobachtet, dass DSIP die Expression von MT (Melatonin), Glu, DA und 5-HT im hippocampalen Gewebe moduliert. Zum Beispiel waren die Melatonin-, Serotonin- und Dopaminspiegel im Hippocampus der Ratten der Modellgruppe im Vergleich zur Kontrollgruppe signifikant reduziert, und diese Neurotransmitterwerte stiegen nach der Verabreichung von DSIP an die Ratten. Dies deutet darauf hin, dass DSIP Schlaf induzieren und regulieren kann, indem es das Gleichgewicht der Neurotransmitter reguliert. Neurotransmitter spielen eine Schlüsselrolle im Schlaf-Wach-Zyklus, wie Serotonin, das an der Regulation von Stimmung, Schlaf und Erregung beteiligt ist; Dopamin, das mit Erregung und Belohnung verbunden ist; und Melatonin, ein wichtiges Hormon, das den zirkadianen Rhythmus reguliert. Die Modulation dieser Neurotransmitter durch DSIP kann helfen, normale Schlaf-Wach-Rhythmen aufrechtzuerhalten [1].
Studien haben gezeigt, dass DSIP nicht nur Schlaf induziert, sondern auch regulatorische Auswirkungen auf die Schlafarchitektur hat. Im Experiment mit Ratten, die chronischer Hypoxie (HH) ausgesetzt waren, wurde phosphoryliertes δ schlafinduzierendes Peptid (P-DSIP) Ratten zur Intervention verabreicht, und es wurde festgestellt, dass es den Schlaf der nicht-schnellen Augenbewegungen (NREM) und den REM-Schlaf verbessert sowie die Schlafarchitektur verbessert. Dies spiegelt die Fähigkeit von DSIP wider, die Schlafarchitektur insgesamt zu optimieren und so eine verbesserte Schlafqualität zu ermöglichen [2].
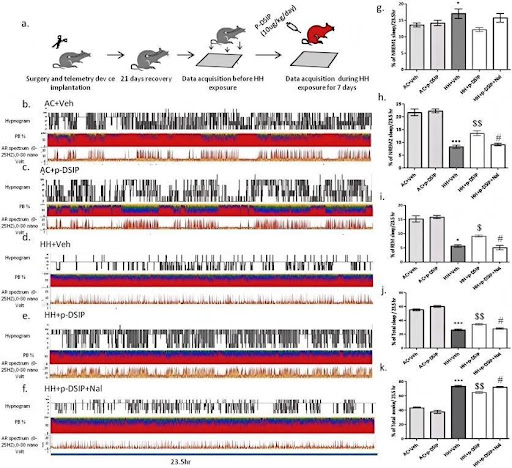
Abb. 1. Schlafarchitektur der Ratten. p-DSIP stellte die veränderte Schlafarchitektur während chronischer Höhenexposition teilweise wieder: a., Schema des experimentellen Aufbaus (rote Farbe der Ratte repräsentiert HH-exponiertes Tier). b., c., d., e., f. sind das Hypnogramm mit dem Prozentsatz des Leistungsbandes und dem AR-Spektrum von AC + Veh, AC + p-DSIP, HH + Veh, HH + p-DSIP, HH + p-DSIP + Nal-Gruppen. Veränderungen im Prozentsatz von g., NREM1-Schlaf, h., NREM2-Schlaf, i., REM-Schlaf, j., Gesamtschlaf, k., Gesamtwach. Ein Einweg-ANOVA mit Bonferroni-Post-hoc-Test wurde zur Analyse des Prozentsatzes von NREM1, NREM2, REM und TST verwendet. Der Wert dargestellt als Mittelwert ± SEM (n = 6 Tiere/Gruppe) *p < 0,05, **p < 0,01, ***p < 0,001 im Vergleich zu AC + Veh, p < 0,05, p < 0,01, p < 0,001 im Vergleich zu HH + Veh, p < 0,05, p < 0,01, p < 0,001 im Vergleich zu HH + p-DSIP + Nal.
Quelle: ELSEVIER [2].
Einige Studien haben darauf hingewiesen, dass DSIP an schlafbezogenen physiologischen Prozessen beteiligt sein könnte. In Schlafentzugsexperimenten beispielsweise erhöhte Schlafmangel die Plasma-GH-Konzentration bei Ratten sowie eine Erhöhung der Menge an SWS, die durch Antiserum, die auf DSIP abzielt, blockiert werden könnte, was darauf hindeutet, dass eine Zunahme der endogenen DSIP-Freisetzung einer der Gründe für den Anstieg von SWS sein könnte und darauf hindeutet, dass DSIP eine physiologisch stimulierende Rolle bei der Freisetzung schlafbezogener Wachstumshormone und bei der Induktion von SWS spielt. Darüber hinaus kann DSIP den Schlaf beeinflussen, indem es die mitochondriale Funktion reguliert. Es wurde festgestellt, dass DSIP die oxidative Phosphorylierungseffizienz isolierter Rattenhirnmitochondrien beeinflusste und die Rate des phosphorylierten respiratorischen V3, die respiratorische Kontrollrate RCR und die Phosphorylierungsrate von ADP erhöhte. Unter hypoxischen Bedingungen hemmte die Vorbehandlung mit DSIP die durch Hypoxie induzierte Abnahme der mitochondrialen Atemwegsaktivität, was möglicherweise mit den stressschützenden und antioxidativen Effekten von DSIP in vivo zusammenhängt, welche wiederum den Schlafprozess beeinflussen [3].
Obwohl der genaue Standort von DSIP im Schlafregulationsweg noch nicht vollständig verstanden ist, lässt sich anhand seiner Auswirkungen auf Neurotransmitter und schlafbezogene physiologische Prozesse vermuten, dass es an mehreren Schlafregulationswegen beteiligt sein könnte. Zum Beispiel kann es den Schlaf regulieren, indem es die Funktion der Hypothalamus-Hypophysen-Nebennierenachse (HPA-Achse) beeinflusst, die eng mit der Stressreaktion und der Schlafregulation zusammenhängt, und DSIP hat einige stressschutzende Effekte. Gleichzeitig kann es mit anderen bekannten Schlafregulatoren interagieren, um das Schlaf-Wach-Gleichgewicht aufrechtzuerhalten, obwohl weitere eingehende Studien erforderlich sind, um seine spezifische Wirkungsweise und Ziele zu klären [4].
DSIP-Studie zur ergänzenden Therapie für neurodegenerative Erkrankungen
Forschung zur Adjuvanstherapie bei Alzheimer (AD): AD ist eine häufige neurodegenerative Erkrankung, die hauptsächlich durch kognitive Beeinträchtigungen und Verhaltensstörungen gekennzeichnet ist, und zu ihren pathologischen Merkmalen gehören die Ablagerung von β-Amyloid (Aβ) und die Hyperphosphorylierung des Tau-Proteins usw. Einige Studien legen nahe, dass DSIP eine adjuvante Therapie spielen könnte, indem es den Stoffwechsel von Aβ reguliert. Einige Studien deuten darauf hin, dass DSIP eine adjuvante therapeutische Funktion spielen könnte, indem es den Aβ-Stoffwechsel reguliert. In in-vitro-zellulären Experimenten konnte DSIP die Verarbeitung des Aβ-Vorläuferproteins (APP) beeinflussen und die Aβ-Produktion reduzieren. Dies könnte daran liegen, dass DSIP die Aktivitäten verwandter Enzyme wie β-Sekretase (BACE1) und γ-Sekretase reguliert, die die wichtigsten ratelimitierenden Enzyme im Prozess der Aβ-Produktion durch APP sind, und DSIP die Aβ-Produktion durch Hemmung der Expression oder Aktivität von BACE1 reduzieren und so die toxischen Auswirkungen der Aβ-Ablagerung auf Neuronen lindert. Außerdem wurde in einem Tiermodell von AD ein Rückgang der Tau-Proteinphosphorylierung nach der Verabreichung von DSIP beobachtet. Die Hyperphosphorylierung des Tau-Proteins kann zur Bildung neurogener faseriger Tangles führen, die die normale Funktion von Neuronen beeinträchtigen können. DSIP kann den Phosphorylierungszustand von Tau-Proteinen beeinflussen, indem es das Gleichgewicht zwischen Proteinkinasen und Phosphatasen reguliert und so die strukturelle und funktionelle Integrität der Neuronen erhält [5, 6] .
Forschung zur adjuvanten Therapie der Parkinson-Krankheit (PD): PD ist hauptsächlich durch motorische Symptome wie Bradykinisie und Tremor gekennzeichnet, und ihre pathologischen Veränderungen sind hauptsächlich auf den degenerativen Tod der nigrostriatalen dopaminergen Neuronen im Mittelhirn zurückzuführen, was zu einem signifikanten Rückgang des striatalen Dopamingehalts führt. Einige Studien haben gezeigt, dass DSIP eine gewisse neuroprotektive Wirkung auf PD-Tiermodelle hat. Einerseits kann DSIP die Symptome von PD verbessern, indem es das Neurotransmittersystem reguliert. Degeneration und Tod dopaminerger Neuronen stören das Gleichgewicht der Neurotransmitter, DSIP kann die Synthese oder Freisetzung von Dopamin fördern oder den Spiegel anderer Neurotransmitter wie γ-Aminobuttersäure (GABA), Glutamat usw. regulieren, um das Gleichgewicht des Neurotransmittersystems wiederherzustellen und die motorische Funktion zu verbessern. DSIP hingegen kann dopaminerge Neuronen schützen, indem es oxidativen Stress hemmt. Es gibt viele oxidative Belastungsschäden im Gehirn von Parkinson-Patienten, und die erhöhte Produktion reaktiver Sauerstoffspezies (ROS) kann zu einer Lipidperoxidation der neuronalen Membran, Protein- und Nukleinsäureschäden führen. DSIP besitzt eine gewisse antioxidative Kapazität, die die zellulären Antioxidenzyme wie Superoxiddismutase (SOD), Glutathionperoxidase (GSH) und Glutathionperoxidase (GSH) erhöhen kann. Peroxidase-(GSH-Px)-Aktivität und reduzierte ROS-Werte [7].
Rolle von DSIP in der posttraumatischen Genesung
Förderung von Schlaf und Körperreparatur: Nach einem Trauma leiden Patienten häufig unter Schlafstörungen, und guter Schlaf ist für die Erholung des Körpers sehr wichtig. DSIP kann die Schlafstruktur regulieren und die Dauer sowie Qualität des Tiefschlafs (δ Schlafs) erhöhen. Während der Tiefschlafphase befinden sich die physiologischen Funktionen des Körpers in einem niedrigen Stoffwechselzustand, und es ist auch eine wichtige Phase für Zellreparatur, Immunregulation und Neuroplastizität. So sondert der Körper beispielsweise während der Reparatur von durch Trauma verursachten Gewebeschäden während des Tiefschlafs mehr Wachstumshormon aus, was die Kollagensynthese fördert und die Wundheilung beschleunigt. DSIP bietet ein günstiges inneres Umfeld für die Selbstreparatur des Körpers, indem es den Schlaf verbessert.
Neuromodulation und funktionelle Erholung: Traumata, insbesondere traumatische Hirnverletzungen, können zu einer beeinträchtigten neurologischen Funktion führen. DSIP hat eine modulierende Wirkung auf das Nervensystem, indem es die Freisetzung und den Stoffwechsel von Neurotransmittern beeinflusst. Studien haben gezeigt, dass DSIP die Spiegel von Neurotransmittern wie Dopamin und Gamma-Aminobuttersäure (GABA) regulieren kann. Dopamin spielt eine wichtige Rolle bei der Aufrechterhaltung von Erregung, Emotionsregulation und motorischer Kontrolle, während GABA der wichtigste inhibitorische Neurotransmitter im zentralen Nervensystem ist und eine Schlüsselrolle bei der Regulierung der neuronalen Erregbarkeit spielt. Nach einem Trauma ist ein Neurotransmitter-Ungleichgewicht häufiger, und DSIP hilft, das Gleichgewicht der neurologischen Funktion wiederherzustellen und die neurologische Genesung zu fördern, indem es die Spiegel dieser Neurotransmitter reguliert.
Immunmodulation und Kontrolle der Entzündungsreaktion: Nach einem Trauma löst der Körper in der Regel eine Immunantwort aus, jedoch kann eine übermäßige Entzündungsreaktion weitere Schäden an Geweben und Organen verursachen. DSIP spielt eine Rolle bei der Immunmodulation, die die Aktivität von Immunzellen und die Sekretion von Zytokinen regulieren kann. Zum Beispiel hemmt DSIP die Freisetzung proinflammatorischer Zytokine wie Tumornekrosefaktor-alpha (TNF-alpha) und Interleukin-6 (IL-6), während es die Produktion entzündungshemmender Zytokine wie Interleukin-10 (IL-10) fördert. Diese Modulation der Entzündungsreaktion hilft, entzündliche Schäden nach einem Trauma zu reduzieren und fördert die Genesung.
Wiederherstellung der motorischen Funktion: Forscher untersuchten SD-Ratten, die nach einem fokalen Schlaganfall, der durch eine Okklusion der mittleren Gehirnarterie (MCAO) ausgelöst wurde, DSIP oder einen nasalen Träger erhielten. Die Ergebnisse zeigten, dass das Volumen des Hirninfarkts zwar in der mit DSIP behandelten Tiergruppe kleiner war als in der trägerbehandelten Gruppe, der Unterschied jedoch nicht signifikant war. Im Baton-Drehtest zeigten die Tiere der mit DSIP behandelten Gruppe jedoch eine signifikante Wiederherstellung der motorischen Leistungsfähigkeit. Dies ist ein direkter Beleg für die Verbesserung der motorischen Funktion bei Ratten nach einem Schlaganfall und legt nahe, dass DSIP eine wichtige Rolle bei der Rehabilitation der motorischen Funktion nach einem Schlaganfall spielen könnte [8] .
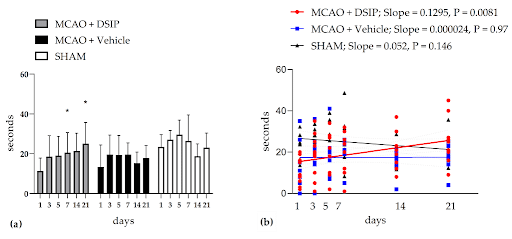
Abb. 2. Latente Fallzeit von einer rotierenden Stange: (a) Die Ergebnisse werden als Gruppenmittelwert ± Standardabweichung dargestellt. * p < 0,01 relativ zum ersten Testtag laut wiederholten Messungen ANOVA, Duncans Test. (b) Lineare Regression wurde verwendet, um die dynamischen Veränderungen der Latenzzeit des Fallens zu bewerten. Die individuellen Werte werden für alle Gruppen an jedem Testtag angegeben. Die Steigungen der linearen Regressionslinien für jede Gruppe werden dargestellt. Die Steigung der Regressionslinie für die mit DSIP behandelte Gruppe unterschied sich signifikant von 0, was darauf hindeutet, dass die Fallzeit vom Testtag abhängt. Somit gab es eine dynamische Verbesserung der Leistung des Rotarod-Tests über 21 Tage Tests an mit DSIP behandelten Tieren.
Quelle: MDPI [9]
Als Peptid mit einzigartigen physiologischen Funktionen hat DSIP breite Anwendungsmöglichkeiten in den Bereichen Schlafregulation, Behandlung neurologischer Erkrankungen und Entwicklung verwandter Gesundheitsprodukte gezeigt. Obwohl in der Forschung zu DSIP einige Fortschritte erzielt wurden, gibt es noch viele Themen, die weiter untersucht werden müssen, wie etwa der präzisere Wirkmechanismus, die optimale klinische Dosierung und Verabreichungsweise usw., um seinen potenziellen Wert voll auszuschöpfen und größere Beiträge zur menschlichen Gesundheit leisten zu können.
Artikelautor
Die oben genannte Literatur wurde von Dr. Velira Nyssén recherchiert, redigiert und organisiert.
Autor wissenschaftlicher Zeitschrift
Dr. Roy Koustav ist ein versierter Forscher mit Verbindung zu mehreren angesehenen Institutionen und zeigt ein vielfältiges und interdisziplinäres akademisches Profil. Derzeit ist Dr. Koustav mit der medizinischen Fakultät der Universität Tsukuba in Tsukuba, Ibaraki, Japan, verbunden und trägt zudem zur World Premier International Research Center Initiative (WPI) der Universität am International Institute for Integrative Sleep Medicine (IIIS) bei, wo er die komplexen Schnittstellen von Schlafwissenschaft und Neurowissenschaften erforscht.
Über seine akademischen Tätigkeiten in Japan hinaus pflegt Dr. Koustav berufliche Verbindungen zur indischen Defence Research & Development Organisation (DRDO) und zum Defence Institute of Physiology & Allied Sciences (DIPAS) und nutzt sein Fachwissen, um Grundlagenforschung mit angewandten Lösungen in verteidigungsbezogenen physiologischen und medizinischen Wissenschaften zu verbinden. Sein Forschungsportfolio umfasst ein breites Spektrum der Lebenswissenschaften, mit Schwerpunkten auf Neurowissenschaften und Neurologie, Pharmakologie und Pharmazie, Verhaltenswissenschaften, Immunologie sowie Forschung und experimenteller Medizin. Durch die Integration von Erkenntnissen aus diesen Disziplinen adressiert Dr. Koustavs Arbeit kritische Herausforderungen in der menschlichen Gesundheit, der physiologischen Anpassung und der translationalen Medizin und spiegelt sein Engagement für akademische Exzellenz und reale Auswirkungen wider.
Zitate Quellenangaben
[1]. Mu X, Qu L, Yin L, Wang L, Liu X, Liu D. Pichia pastoris sezernierte Peptide, die die Blut-Hirn-Schranke überquerten, und die Wirksamkeit der DSIP-Fusionspeptide in PCPA-induzierten Schlaflosigkeits-Mausmodellen. VORDERE PHARMACOL. 2024; 15. https://api.semanticscholar.org/CorpusID:273205621
[2]. Roy K, Chauhan G, Kumari P, Wadhwa M, Alam S, Rai K, Panjwani U, Kishore K.
Das phosphorylierte delta-schlafinduzierende Peptid stellt das räumliche Gedächtnis und die p-CREB-Expression wieder her, indem es die Schlafarchitektur in großer Höhe verbessert. LIFE SCI. 2018;209:282-90. https://doi.org/10.1016/j.lfs.2018.08.026
[3]. Khvatova EM, Samartzev VN, Zagoskin PP, Prudchenko IA, Mikhaleva II. Delta-Schlafinduzierendes Peptid (DSIP): Wirkung auf die Atmungsaktivität in Rattenhirnmitochondrien und die stressschutzende Wirkung unter experimenteller Hypoxie. PEPTIDE. 2003; 24(2):307-11. https://doi.org/10.1016/S0196-9781(03)00040-8
[4]. Belykh A, Bobyntsev I. Delta-schlafinduzierendes Peptid: mehrere biologische Effekte und Mechanismen ihrer Entstehung. Kursker Wissenschaftliches und Praktisches Bulletin "Der Mensch und seine Gesundheit. 2016 0003-01-03:79-90
[5]. N MIAD, Posadas I. Dendrimer bei neurodegenerativen Erkrankungen. ABLÄUFE. 2023. https://api.semanticscholar.org/CorpusID:256052180
[6]. Xin Z. Neurodegenerative Erkrankungen und ihre damit verbundene Behandlung. E3S Web der Konferenzen. 2021 0001-01-01; 271:3020.10.1051/e3sconf/202127103020
[7]. Lange KW. Lipide bei der Behandlung neurodegenerativer Erkrankungen.: John Wiley & Sons, Ltd; 2020. S. 1-17. https://onlinelibrary.wiley.com/doi/abs/10.1002/047167849X.bio118
[8]. Schneider-Helmert D. Auswirkungen von DSIP auf Narkolepsie. EUR NEUROL. [Fallberichte; Fachartikel]. 1984 1984-01-19; 23(5):353-7.10.1159/000115713
[9]. Tukhovskaya EA, Ismailova AM, Shaykhutdinova ER, Slashcheva GA, Prudchenko IA, Mikhaleva II, Khokhlova ON, Murashev AN, Ivanov VT. Das Delta-Schlafinduzierende Peptid stellt die motorische Funktion bei SD-Ratten nach einem fokalen Schlaganfall wieder her. MOLEKÜLE. 2021; 26(17},ARTIKEL-NUMMER = {5173).10,3390/molecules26175173
ALLE ARTIKEL UND PRODUKTINFORMATIONEN AUF DIESER WEBSITE DIENEN AUSSCHLIESSLICH ALS REFERENZ UND ZU BILDUNGSZWECKEN.
Die angebotenen Produkte sind streng für die In-vitro-Forschung vorgesehen (vom Latein: "in Glas"), was sich auf Studien außerhalb lebender Organismen bezieht. Diese Substanzen stellen keine pharmazeutischen Medikamente dar und wurden nicht von der US-amerikanischen Food and Drug Administration (FDA) zur Prävention, Behandlung oder Heilung von medizinischen Erkrankungen, Krankheiten oder Störungen geprüft oder zugelassen. Nach gesetzlichen Bestimmungen ist jegliche Einführung dieser Produkte in menschliche oder tierische biologische Systeme, unabhängig von der Verabreichungsmethode, ausdrücklich verboten.