Kisspeptin ist ein Neuropeptid, das vom KISS1-Gen codiert wird. Es wurde erstmals 1996 von Wissenschaftlern wie Lee entdeckt, als es Melanome untersuchte, wo es als Metastasesuppressor (Metastin) bekannt war. Im Verlauf der Forschung wurde er zu einem zentralen Regulator im Bereich der reproduktiven Neuroendokrinologie, und 2003 identifizierten Forscher ihn als Regulator der Funktion der hypothalamus-hypophysen-gonadalen (HPG-Achse) über den GPR54-Rezeptor (heute bekannt als KISS1R), eine Entdeckung, die seine entscheidende Rolle beim Beginn der Pubertät und der Regulation der Fortpflanzung offenbarte. Als zentraler Upstream-Regulator von GnRH-Neuronen integriert Kisspeptin Sexualhormon-Rückkopplung, metabolische Signalgebung und Umweltrhythmen und ist damit ein Schlüsselmolekül, das die Energie-Homöostase und Fortpflanzungsfunktion verbindet. In den letzten Jahren haben weitere Studien den Anwendungsbereich erweitert und festgestellt, dass sie das Sexualverhalten, die Emotionsregulation und Stoffwechselerkrankungen reguliert, was neue Ziele für die Behandlung reproduktiver endokriner Erkrankungen bietet.
Was ist Kisspeptin?
Kisspeptin, codiert vom KiSS-1-Gen, ist ein Peptidhormon, das erstmals 1996 von Forschern in den Vereinigten Staaten entdeckt wurde und ein Produkt codiert, das hydrolysiert werden kann, um verschiedene amidierte kurze Peptide unterschiedlicher Länge zu produzieren, wie Kisspeptin-54, Kisspeptin-14, Kisspeptin-13 und Kisspeptin-10. Kisspeptin-14, Kisspeptin-13 und Kisspeptin-10. Diese kurzen Peptide besitzen alle Arginin- und Phenylalanin-Strukturen am C-Terminus. Der Rezeptor für Kisspeptin ist der G-Protein-gekoppelte Rezeptor 54 (GPR54), der zur Familie der G-Protein-gekoppelten Rezeptoren gehört. Wenn Kisspeptin an GPR54 bindet, aktiviert es eine Reihe von nachgeschalteten Signalwege, um seine biologische Funktion zu erfüllen.
Kisspeptin-Struktur
Kisspeptin-Forschung
Rolle von Kisspeptin im Fortpflanzungssystem
Pubertätsinitiation: Kisspeptin ist ein zentrales Signalmolekül für den Beginn der Pubertät. Während der präpubertären Phase ist die Aktivität der hypothalamischen Kisspeptin-Neuronen relativ gering. Mit näherer Pubertät werden diese Neuronen allmählich aktiviert und ihre Sekretion erhöht, was die Aktivierung der HPG-Achse auslöst, wodurch der Körper in die Pubertät eintritt und eine Reihe von Veränderungen wie die Entwicklung sekundärer Geschlechtsmerkmale und die Reifung der Fortpflanzungsorgane auftreten. Die Bedeutung von Kisspeptin beim Beginn der Pubertät wird weiter durch klinische Studien belegt, die gezeigt haben, dass eine Mutation in den KISS1- oder KISS1R-Genen zu Auffälligkeiten in der pubertätlichen Entwicklung führen kann, wie etwa der zentralen vorzeitigen Pubertät (CPP) oder idiopathischem hypogonadotropem Hypogonadismus (IHH) [1, 2].
Regulierung des Fortpflanzungszyklus: Bei erwachsenen Frauen ist Kisspeptin an der Regulation des Menstruationszyklus beteiligt. Während verschiedener Phasen des Menstruationszyklus verändert sich die Sekretion von Kisspeptin im hypothalamischen Zyklus zyklisch, was mit den Sekretionsrhythmen von GnRH, LH und FSH koordiniert wird, um den Eisprung, den Endometriumzyklus und die Sekretion von Sexualhormonen zu regulieren. Bei Männern ist Kisspeptin auch für die Aufrechterhaltung der normalen Hodenfunktion, der Spermatogenese und der Androgensekretion unerlässlich [1, 2].
Kisspeptin spielt eine Schlüsselrolle bei der Regulation der Fortpflanzung, hauptsächlich über die Hypothalamus-Hypophysen-Gonade al (HPG)-Achse. Bestimmte Neuronen im Hypothalamus, wie die im arkuaten und paraventrikulären Kern, synthetisieren und sekretieren Kisspeptin, das an den Rezeptor GPR54 bindet und die neuronale Aktivität des gonadotropinfreisetzenden Hormons (GnRH) stimuliert, was zu einer Steigerung der Synthese und Freisetzung von GnRH führt, das dann in das Hypophysenhilarsystem eintritt, wo es auf die vordere Hypophyse wirkt, um die Freisetzung von Gonadotropinen (luteinisierendem Hormon) zu stimulieren. GnRH gelangt dann in das Hypophysenportalsystem, wo es auf die vordere Hypophyse wirkt, um die Synthese und Sekretion von Gonadotropinen (luteinisierendes Hormon (LH) und follikelstimulierendes Hormon (FSH)) zu stimulieren, die wiederum auf die Gonaden (Hoden oder Eierstöcke) wirken, um die gonadale Entwicklung, die Synthese und Sekretion von Sexualhormonen (Testosteron, Östrogen, Progesteron usw.) sowie die Produktion von Gameten (Spermatozoen oder Eizellen) zu stimulieren und so die Fortpflanzungsfunktion zu regulieren. Zum Beispiel nimmt während des Beginn der Pubertät die Aktivität der Kisspeptin-Neuronen allmählich zu und es wird mehr Kisspeptin ausgeschieden, was die HPG-Achse durch den oben genannten Mechanismus aktiviert und zum Beginn der Pubertät führt. Bei erwachsenen Menschen ist Kisspeptin auch für die Aufrechterhaltung normaler Rhythmen im Fortpflanzungszyklus unerlässlich [1-3].
Rolle von Kisspeptin im Stoffwechselsystem Rolle von Kisspeptin im Fortpflanzungssystem
Pubertätsinitiierung: Kisspeptin ist ein zentrales Signalmolekül für den Beginn der Pubertät. Vor der Pubertät haben hypothalamische Kisspeptin-Neuronen eine relativ geringe Aktivität. Mit näherer Pubertät werden diese Neuronen allmählich aktiviert und ihre Sekretion erhöht, was die Aktivierung der HPG-Achse auslöst, wodurch der Körper in die Pubertät eintritt und eine Reihe von Veränderungen wie die Entwicklung sekundärer Geschlechtsmerkmale und die Reifung der Fortpflanzungsorgane auftreten. Die Bedeutung von Kisspeptin beim Beginn der Pubertät wird weiter durch klinische Studien belegt, die gezeigt haben, dass eine Mutation in den KISS1- oder KISS1R-Genen zu Auffälligkeiten in der pubertätlichen Entwicklung führen kann, wie etwa der zentralen vorzeitigen Pubertät (CPP) oder idiopathischem hypogonadotropem Hypogonadismus (IHH)[1, 2].
Rolle von Kisspeptin im Stoffwechselsystem
Regulierung des Energiehaushalts: Kisspeptin und seine Neuronen haben appetithemmende Effekte, die die Nahrungsaufnahme reduzieren und somit das Energiegleichgewicht des Körpers erhalten können. Es wurde festgestellt, dass in Tiermodellen der Fettleibigkeit die Expression von Kisspeptin im Hypothalamus verändert ist und diese Veränderung das Appetitregulationszentrum beeinflussen kann, was zu einem Ungleichgewicht zwischen Energieaufnahme und -verbrauch führt und somit die Entwicklung von Fettleibigkeit fördert. Darüber hinaus könnte Kisspeptin auch an der Regulation der Energiehomöostase beteiligt sein, indem es die Funktion des braunen Fettgewebes reguliert und den Energieverbrauch sowie die Thermogenese beeinflusst [3, 4].
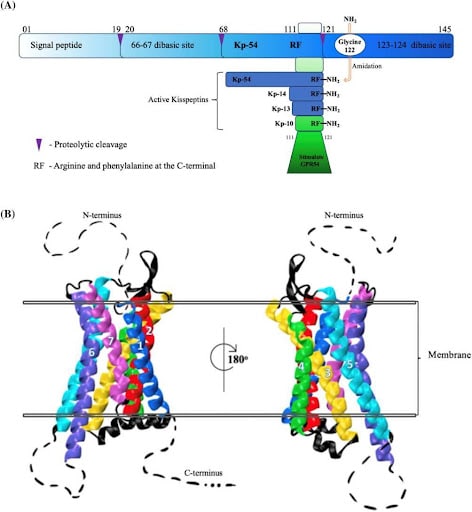
Abb. 1. Kisspeptin und die menschliche GPR54-Struktur. (A) Schaltplan, das das Pre-Pro-Kisspeptin und den proteolytischen Spaltungsweg zeigt, aus dem die aktiven Kisspeptine Kp-10, Kp-13, Kp-14 und Kp-54 entstehen. (B) Die dreidimensionale Kryo-EM-Struktur von CPR54 (SWISS-MODEL, SMLT ID: 7xjk.1).12Die Membrandoppelschicht wird durch die schwarzen Doppellinien und die transmembranen Helices von CPR54 angezeigt, farbig und nummeriert (Helix1: blau, Helix2: rot, Helix3: gelb, Helix4: grün, Helix5: cyan, Helix6: violett und Helix7: rosa), während die extrazellulären und intrazellulären Schleifen schwarz dargestellt sind. Die gestrichelten Linien zeigen die fehlenden Segmente der gemeldeten Kristallstruktur von GPR54 an. Das Image wurde mit der VMD-Software erstellt.13GPR54, G-Protein-gekoppelter Rezeptor; KP, Kisspeptin.
Quelle: PubMed [4]
Glukoseregulation: Es wurde vermutet, dass Kisspeptin an der Regulierung des Blutzuckers beteiligt sein könnte. Einerseits kann es eine regulatorische Wirkung auf die Insulinsekretion haben und die Blutzuckeraufnahme und -nutzung regulieren, indem es die Funktion der Bauchspeicheldrüseninselzellen beeinflusst. Andererseits kann sie den Blutzuckerspiegel beeinflussen, indem sie den Leberglukosestoffwechsel beeinflusst, wie etwa die Glykogensynthese und -abbau. Allerdings sind weitere tiefgehende Studien zum spezifischen Mechanismus der Blutzuckerregulation durch Kisspeptin erforderlich [4].
Neuere Studien haben gezeigt, dass Kisspeptin an der Regulation des Körperstoffwechsels beteiligt ist und dass es einen sexuellen Dimorphismus in dieser Regulation gibt. Einerseits kann Kisspeptin den Stoffwechsel über einen indirekten Weg beeinflussen, also durch die Regulierung der Sekretion von Gonadenhormonen. Gonadalhormone spielen eine wichtige Rolle im Energiestoffwechsel und bei der Fettverteilung, und die Regulation der Gonadenhormone durch Kisspeptin beeinflusst indirekt das Stoffwechselgleichgewicht des Körpers. Kisspeptin hingegen kann auch direkt auf Kisspeptin-Rezeptoren im Gehirn, im braunen Fettgewebe und der Bauchspeicheldrüse wirken und direkt an der Stoffwechselregulation teilnehmen. Im Gehirn interagieren Kisspeptin-Neuronen mit anderen Neuronen, die an der Regulation der Energie-Homöostase beteiligt sind, wie etwa mit der Regulation des Appetits, um das Ernährungsverhalten und den Energieverbrauch des Körpers zu beeinflussen. Im braunen Fettgewebe kann Kisspeptin die Lipolyse und Thermogenese beeinflussen und den Energiestoffwechsel regulieren. In der Bauchspeicheldrüse kann es die Funktion der Pankreasinselzelle beeinflussen, indem es die Insulinsekretion reguliert, was wiederum den Glukosestoffwechsel beeinflusst [4].
Kisspeptin in der Tumortherapie
Kisspeptin förderte in Studien mit rinderlichen Ovarialgranulosenzellen die Apoptose signifikant. Die Zugabe von Kp-10 zum Kulturmedium der rinderlichen Granulosenzellen führte zu einer Hochregulation der Caspase-3-, Fas- und Fasl-mRNA-Expression sowie einer Downregulation der Bcl-2-mRNA-Expression; Caspase-3 ist eine Schlüsselprotease bei der Apoptose, Fas und Fasl sind am todesrezeptor-vermittelten apoptotischen Weg beteiligt, und Bcl-2 ist ein anti-apoptotisches Protein. Diese Veränderungen in der Genexpression deuten darauf hin, dass Kisspeptin die Apoptose fördert, indem es die Expression apoptose-bezogener Gene reguliert. Obwohl es sich um eine Studie an ovarialen Granulosenzellen handelt, legt dies nahe, dass Kisspeptin in Tumorzellen einen ähnlichen pro-apoptotischen Mechanismus haben könnte, der das Tumorwachstum hemmt, indem es intrazelluläre apoptotische Signalwege aktiviert und Tumorzellen zur Apoptose antreiben kann [5].
Tumorwachstum und Metastasen hängen von der Neovaskularisation ab, um Nährstoff- und Metastasierungswege bereitzustellen. Mehrere Studien haben spekuliert, dass Kisspeptin den Tumorfortschritt hemmen kann, indem es die Angiogenese des Tumors beeinflusst. Kisspeptin, das von Tumorzellen ausgeschieden wird, kann auf vaskuläre Endothelzellen im Tumormikroumfeld wirken, um die Expression oder Aktivität angiogenese-bedingter Faktoren wie dem vaskulären endothelialen Wachstumsfaktor (VEGF) zu regulieren, wodurch die Proliferation, Migration und Lumenbildung der Gefäßendothelzellen beeinflusst und die Tumorneovaskularisation verringert wird, wodurch das Wachstum und die Metastasierung des Tumors begrenzt werden [5].
Kisspeptin zeigt einen einzigartigen Wirkmechanismus in der Forschung zu Knochenmetastasen am Brustkrebs. Die bioinformatische Analyse einer großen Anzahl von Brustkrebspatientenproben zeigte, dass die Expression von GPR54 bei Luminal-Brustkrebs signifikant erhöht ist und dass ER- und PR-Positivität stark mit der Expression von GPR54 korreliert. Unterdessen war der Anteil an hochexprimiertem GPR54 bei Brustkrebs-Knochenmetastasenproben höher als bei primären Brustkrebsproben. Weitere Studien zeigten, dass Kp-10 die Migration von Brustkrebs-BT474-Zellen sowie die durch Brustkrebszellen induzierte Osteoklastdifferenzierung und die Expression von knochenmetastasischen Genen wie OPN, MMP1, CTGF, IL-11 und RANKL signifikant förderte. Tierversuche bestätigten außerdem, dass Kp-10 die Knochenmetastasen und Knochenabbau in der Brustkrebszelle BT474 signifikant fördern könnte. Dies deutet darauf hin, dass Kisspeptin während der Brustkrebs-Knochenmetastase die Besiedlung und das Wachstum von Tumorzellen im Knochengewebe fördern kann, indem es die Interaktion zwischen Tumorzellen und der Knochenmikroumgebung reguliert, und sein spezifischer Mechanismus die Aktivierung und Regulation mehrerer Signalwege umfassen kann [6].
Als Neuropeptid mit mehreren biologischen Funktionen hat Kisspeptin bedeutende Forschungswerte und Anwendungsmöglichkeiten in den Bereichen Fortpflanzung, Stoffwechsel und Tumorbiologie gezeigt.
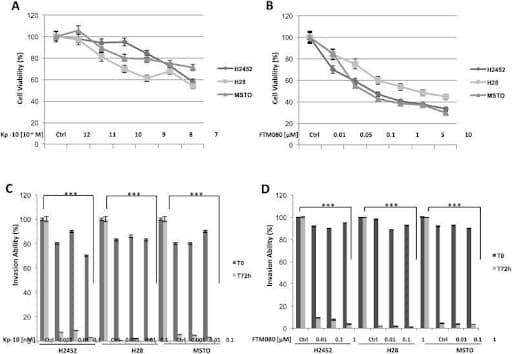
Abb. 2.(A-B) Zelllebensfähigkeit, (C-D) Invasionsfähigkeit. Die Daten sind der durchschnittliche ± SD von drei unabhängigen Experimenten, die jeweils dreifach durchgeführt wurden. Asterisken zeigen statistische Signifikanz an, wie sie durch den Student-t-Test bestimmt wird (*** P ≤ 0,001).
Quelle: PubMed[6]
Artikelautor
Die oben genannte Literatur wurde von Dr. Velira Nyssén recherchiert, redigiert und organisiert.
Autor wissenschaftlicher Zeitschrift
Oyedokun, P. A., angegliedert an die Abteilung für Physiologie der Ladoke Akintola University of Technology in Ogbomosho, Oyo, Nigeria, sowie Oasis Grace Hosp, verfügt über ein vielseitiges akademisches und berufliches Profil. Mit einem Schwerpunkt, der sich über verschiedene wissenschaftliche Bereiche erstreckt, darunter Toxikologie, Biochemie & Molekularbiologie, Zellbiologie, Pharmakologie & Pharmazie sowie Reproduktionsbiologie, hat Oyedokun ein breit angelegtes Forschungsportfolio aufgebaut. Dieser interdisziplinäre Ansatz spiegelt das Bekenntnis wider, komplexe biologische und medizinische Fragestellungen zu erforschen und so zum Fortschritt des Wissens in diesen kritischen Bereichen beizutragen. Wie ein algorithmisch generiertes Autorenverzeichnis nahelegt, integriert Oyedokuns Arbeit wahrscheinlich innovative rechnergestützte Methoden mit traditioneller wissenschaftlicher Forschung und erweitert so die Tiefe und Reichweite der Forschungsergebnisse.
Zitate Quellenangaben
[1]. Sharma A. Umfang von Kisspeptin bei neuroendokrinen Störungen. 2023 0007-01-07:{} https://www.researchgate.net/publication/371982066_Scope_of_Kisspeptin_in_Neuroendocrine_Disorder
[2]. S L, S E. Kisspeptin: Brücke zwischen Physiologie und klinischer Anwendung in der Regulation der HPG-Achsen. International Journal of Advanced Biochemistry Research. 2024 10.33545/26174693.2024.v8.i2sd.579
[3]. Oyedokun PA, Akangbe MA, Akhigbe TM, Akhigbe RE. Regulatorische Beteiligung von Kisspeptin an der Energiebilanz und -reproduktion. ZELLBIOCHEMIE BIOPHYSIK. 2024. https://api.semanticscholar.org/CorpusD:272912423
[4]. Sliwowska JH, Woods NE, Alzahrani AR, Paspali E, Tate RJ, Ferro VA. Kisspeptin ist ein potenzielles therapeutisches Ziel bei der Behandlung sowohl metabolischer als auch reproduktiver Funktionsstörungen. J DIABETES. 2024; 16(4):e13541. https://doi.org/10.1111/1753-0407.13541
[5]. Kim T, Yoon JH, Cho S. Kisspeptin fördert die Invasivität von Glioblastomzellen über den Gq-PLC-PKC-Weg. ANTICANCER RES. [Fachartikel]. 2020 2020-01-01; 40(1):213-20.10.21873/anticanres.13942
[6]. Ciaramella V, Della Corte CM, Di Mauro C, Tomassi S, Di Maro S, Troiani T, Martinelli E, Bianco R, Cosconati S, Pierantoni R, Meccariello R, Chianese R, Ciardiello F, Morgillo F. Antitumorwirksamkeit von Kisspeptin in humanen malignen Mesotheliomzellen. Oncotarget. [Fachartikel]. 2018 2018-04-10; 9(27):19273-82.10.18632/oncotarget.25018
ALLE ARTIKEL UND PRODUKTINFORMATIONEN AUF DIESER WEBSITE DIENEN AUSSCHLIESSLICH ALS REFERENZ UND ZU BILDUNGSZWECKEN.
Die angebotenen Produkte sind streng für die In-vitro-Forschung vorgesehen (vom Latein: "in Glas"), was sich auf Studien außerhalb lebender Organismen bezieht. Diese Substanzen stellen keine pharmazeutischen Medikamente dar und wurden nicht von der US-amerikanischen Food and Drug Administration (FDA) zur Prävention, Behandlung oder Heilung von medizinischen Erkrankungen, Krankheiten oder Störungen geprüft oder zugelassen. Nach gesetzlichen Bestimmungen ist jegliche Einführung dieser Produkte in menschliche oder tierische biologische Systeme, unabhängig von der Verabreichungsmethode, ausdrücklich verboten.














