KPV ist ein Tripeptid, das aus Lysin (Lysin), Prolin (Prolin) und Valin (Valin) gebildet wird und durch Peptidbindungen verbunden ist. Es ist natürlich im Hormon α-melanozytenstimulierendes Hormon (α-MSH) vorhanden und ist das C-terminale aktive Fragment von α-MSH. Als bioaktives Peptid hat KPV in den letzten Jahren viel Aufmerksamkeit für seine bemerkenswerten entzündungshemmenden und antibakteriellen Eigenschaften erregt, insbesondere in den Bereichen Entzündungsmodulation, Infektionskontrolle und Wundheilung, was einen potenziellen Anwendungswert zeigt.
Was ist KPV?
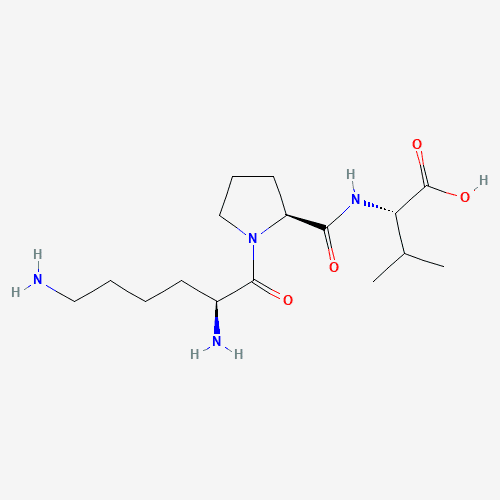
KPV ist ein Tripeptid, das aus Lysin (K), Prolin (P) und Valin (V) besteht und durch eine Peptidbindung verbunden ist. Diese spezifische Aminosäuresequenz verleiht KPV einzigartige chemische und biologische Eigenschaften. Aminosäuren sind die grundlegenden Bausteine von Proteinen, und verschiedene Aminosäurekombinationen und -sequenzen bestimmen die funktionellen Eigenschaften von Peptiden. Bei KPV hat Lysin eine basische Aminogruppe, Prolin eine spezielle zyklische Struktur und Valin hydrophobe Seitenketten. Zusammen beeinflussen diese strukturellen Merkmale die Wechselwirkung von KPV mit Molekülen in lebenden Organismen.
KPV-Struktur
KPV Forschung
Entzündungshemmende Wirkung von KPV
Rolle bei Colitis ulcerosa: Mehrere Studien haben gezeigt, dass KPV eine signifikante therapeutische Wirkung auf UC hat. In einem DSS-induzierten Mausmodell von UC führte die Behandlung mit KPV zu einer früheren Gewichtszunahme, einer signifikanten Reduktion der entzündlichen Infiltrationen und einer Abnahme der Myeloperoxidase-(MPO)-Aktivität im Darmgewebe, was darauf hindeutet, dass KPV die Entzündungsreaktion abschwächen kann. Nachdem KPV in hyaluronsäurefunktionalisierte Polymer-Nanopartikel (HA - KPV - NP) geladen wurde, konnten die Nanopartikel erfolgreich KPV-gezielte Abgabe an wichtige UC-Behandlungszellen wie Kolonepithelzellen und Makrophagen vermitteln. Orale Verabreichung von HA – KPV – NPs, die in einem Hydrogel (Chitosan / Alginat) eingeschlossen sind, mit verbesserter Fähigkeit, Schleimhautschäden zu verhindern und TNF herunterzuregulieren – α für UC therapeutischer war [1].
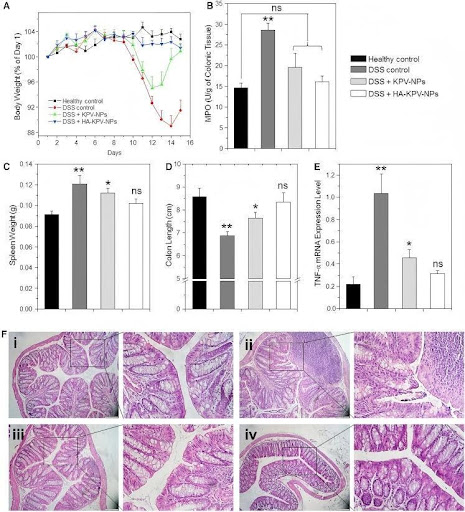
Abb. 1. Orale Verabreichung von KPV-NP- oder HA-KPV-NP-eingebettetem Hydrogel lindert DSS-induzierte UC bei Mäusen
Das Körpergewicht der Maus über die Zeit, normalisiert als Prozentsatz des Körpergewichts am ersten Tag und als Mittelwert jeder Behandlungsgruppe angegeben. (B–E) Colon-MPO-Aktivität (B), Milzgewicht (C), Dickdarmlänge (D) und TNF-α mRNA-Expression (E) in verschiedenen Behandlungsmäusegruppen. Die MPO-Ergebnisse werden als Einheiten der MPO-Aktivität pro Gramm Gewebe angegeben. Jeder Punkt repräsentiert den Mittelwert ± SEM (n = 5). Die statistische Signifikanz wurde mit ANOVA bewertet, gefolgt von einem Bonferroni-Nachtest (*p < 0,05, **p < 0,01). (F) Repräsentative H&E-gefärbte Dickdarmschnitte von DSS-behandelten Mäusen, verabreicht mit täglichen doppelten Gavages von Hydrogel bei verschiedenen NPs für 6 Tage: (i) gesunde Kontrollmäusegruppe, (ii) DSS-behandelte Mäusegruppe, (iii) KPV-behandelte Mäusegruppe und (iv) HA-KPV-NP-behandelte Mäusegruppe. Die Skalenbalken repräsentieren 100 μm.
Quelle: PubMed [1]
Rolle bei chemotherapieinduzierter oraler Schleimhautentzündung: Die durch Chemotherapie ausgelöste orale Mukositis ist aufgrund lokaler bakterieller Infektionen und schwerer Entzündung schwer von selbst zu heilen. Es wurde festgestellt, dass die Auflösung von KPV in einem in situ schleimhauthaften Hydrogel (KPV@PPP_2% E) eine positive therapeutische Wirkung auf die durch Chemotherapie induzierte orale Schleimhauutis hatte. Das Hydrogel erhält nicht nur die entzündungshemmende Wirkung und das Potenzial, die Zellmigration zu fördern, von KPV zu fördern, sondern zeigt auch eine starke antimikrobielle Wirksamkeit gegen Staphylococcus aureus. Die Behandlung mit KPV@PPP_2%-E-Hydrogel verbesserte die Nahrungsaufnahme und die Erholung des Körpergewichts signifikant bei Ratten mit chemotherapiebedingter Mundschleimhautentzündung, förderte die histomorphometrische Reparatur der ulzerierten Gingiv, hemmte die Expression der entzündlichen Zytokine IL-1β und TNF-α und erhöhte die regulierte IL-1 [2].
KPV hemmt die Aktivierung der entzündlichen Signalwege von NF-κB und MAP-Kinase. In menschlichen Darmepithelzellen (Caco2 - BBE und HT29 - Cl.19A) und humanen T-Zellen (Jurkat) hemmten nanomolare KPV-Konzentrationen die Aktivierung von NF - κB und reduzierten die Sekretion proinflammatorischer Zytokine, wenn sie mit pro-inflammatorischen Zytokinen stimuliert wurden.9 Die Aktivierung von NF - κB, einem wichtigen Transkriptionsfaktor, der eine zentrale Rolle bei Entzündungsreaktionen spielt, führt zur Aktivierung einer Vielzahl pro-inflammatorischer Zytokine. Chemokine und Chemotaxis. NF-κB ist ein zentraler Transkriptionsfaktor, der eine zentrale Rolle in der Entzündungsreaktion spielt, und seine Aktivierung kann zu einer Erhöhung der Expression verschiedener proinflammatorischer Zytokine, Chemokine und Adhäsionsmoleküle führen. Darüber hinaus trägt die Hemmung des MAP-Kinase-Entzündungssignalwegs durch KPV auch dazu bei, die Produktion entzündlicher Mediatoren zu reduzieren und bewirkt somit entzündungshemmende Wirkungen [3].
PepT1 ist ein Dipeptid/Tripeptid-Transporterprotein, das normalerweise im Dünndarm exprimiert und während einer entzündlichen Darmerkrankung (IBD) im Dickdarm induziert wird. Studien haben gezeigt, dass die entzündungshemmenden Effekte von KPV durch PepT1 vermittelt werden. Die Kinetik der KPV-Aufnahme wurde in zellulären Aufnahmetests charakterisiert, bei denen entweder kaltes KPV als Konkurrent zu hPepT1-radiomarkierten Substraten oder [³H] KPV verwendet wurde, das über hPepT1 in Immunzellen und Darmepithelzellen eindringt. Dieser Aufnahmemechanismus ermöglicht es KPV, gezielt in die interessierten Zellen einzudringen, um seine entzündungshemmenden Wirkungen zu entfalten. Zum Beispiel kann KPV bei der Behandlung von UC durch PepT1 Zugang zu Colonepithelzellen und Makrophagen erhalten, das im entzündeten Dickdarm exprimiert wird, wodurch intrazelluläre Entzündungssignalwege moduliert und die Entzündungsreaktion abgeschwächt wird [3].
KPV ist in der Lage, die Expression von Zytokinen zu regulieren und pro-inflammatorische sowie antiinflammatoriske Zytokine auszubalancieren. In mehreren Entzündungsmodellen wurden nach KPV-Behandlung eine Abnahme der Expression proinflammatorischer Zytokine wie Tumornekrosefaktor α (TNF - α), Interleukin 6 (IL - 6) und IL - 1β sowie eine Hochregulation der Expression entzündungshemmender Zytokine wie IL - 10 beobachtet.23 TNF - α ist ein wichtiges proinflammatorisches Zytokin, das eine Schlüsselrolle bei der Initiierung und Amplifikation von Entzündungsreaktionen spielt. - Die Absenkung von TNF-α durch KPV kann die Intensität der Entzündungsreaktion effektiv verringern. Die Herunterregulierung von TNF-α durch KPV kann die Intensität der Entzündungsreaktion effektiv verringern, während die Hochregulation von IL-10, einem Zytokin mit entzündungshemmenden Eigenschaften, dazu beitragen kann, die Entzündungsreaktion zu hemmen und die Gewebereparatur zu fördern. KPV schafft ein Mikroumfeld, das Entzündungsminderung und Gewebereparatur fördert, indem es das Gleichgewicht dieser Zytokine reguliert [2].
Untersuchung von KPV bei verschiedenen Geweberestaurationen
Orale Schleimhautreparatur
Chemotherapie-induzierte orale Mukositis ist aufgrund lokaler bakterieller Infektionen und schwerer Entzündung schwer selbst zu reparieren. Ein in situ schleimhauthaftes Adhäsions-Hydrogel (PPP_E) basierend auf temperatursensitivem PLGA - PEG - PLGA (PPP) und Epigallocatechin-Gallat (EGCG) mit intrinsischer antimikrobieller Aktivität als Schleimverstärker wurde hergestellt und KPV darin gelöst, um KPV@PPP_2% E-Hydrogel herzustellen. Das Hydrogel hatte eine geeignete Gelationstemperatur, einen Zeit- und Energiespeichermodul und eine starke antimikrobielle Wirksamkeit gegen Staphylococcus aureus. In einem Rattenmodell der chemotherapiebedingten oralen Schleimhaut verbesserte KPV@PPP_2% E-Hydrogel signifikant die Nahrungsaufnahme und die Körpergewichtserholung der Ratten, förderte die Expression von CK10 und PCNA zur Reparatur der Histomorphologie der ulcerierten Gingiva, unterdrückte signifikant die entzündlichen Zytokine IL-1β und TNF-α und erhöhte IL-10, was darauf hindeutet, dass KPV zur Reparatur der oralen Schleimhaut mit Hilfe spezifischer Hydrogele eingesetzt werden kann. Dies deutet darauf hin, dass KPV mit Hilfe spezifischer Hydrogelträger die Rolle eines entzündungshemmenden, antibakteriellen und Gewebereparaturs bei der oralen Schleimhaut übernehmen kann [2].
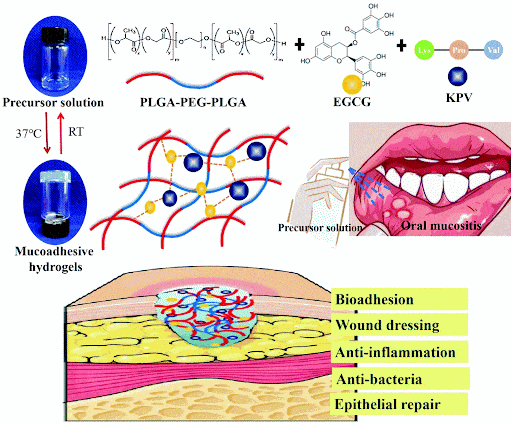
Feige.2. Schema des mukoadistischen KPV@PPP_E Hydrogels bei chemotherapieinduzierter oraler Mukositis.
Quelle: PudMed [2]
Reparatur der Darmschleimhaut
Bei ulceröser Colitis (UC) wurde ein duales Netzwerk-Hydrogel (PMSP) konstruiert, das aus maleimidierter γ-Polyglutaminsäure und thiolierter γ-Polyglutaminsäure besteht, die durch Thiol-Maleimid-Vernetzung und autooxidierte Thiole gebildet wird. PMSP ist negativ geladen und haftet speziell an entzündeter statt gesunder Schleimhaut mit positiv geladenen Proteinen.8 KPV als Modellmedikament kann von PMSP durch elektrostatische Wechselwirkungen erfasst werden. KPV als Modellmedikament kann durch elektrostatische Wechselwirkungen von PMSP eingefangen werden und behält seine biologische Aktivität unter hohen Temperaturbedingungen über einen längeren Zeitraum aufrecht. Nach intrakolonischer Verabreichung verbesserte PMSP signifikant die lindernde Wirkung von KPV auf TNBS-induzierte Kolitis bei Ratten, stellte effektiv die Kolonepithelbarriere wieder her, modulierte die Darmflora und erhöhte die Häufigkeit nützlicher Mikroorganismen. Der therapeutische Mechanismus könnte mit der Hemmung des oxidativen Stresses zusammenhängen, was darauf hindeutet, dass KPV zur Reparatur der Darmschleimhaut durch einen spezifischen Hydrogelträger eingesetzt werden kann, um eine gezielte Wirkung auf die Läsionsstelle zu erzielen, Gewebereparatur zu fördern und die intestinale Mikroökologie zu regulieren [4].
KPV konnte beispielsweise in oralen Schleimhautzitis- und Kolitismodellen die Expression von entzündlichen Zytokinen hemmen, KPV@PPP_2 % E-Hydrogel und PMSP-KPV entzündliche Faktoren wie IL-1β und TNF-α signifikant hemmten und den entzündungshemmenden Faktor IL-1058 hochregulierten, was darauf hindeutet, dass KPV den entzündungsbedingten Signalweg regulieren, die Überaktivierung der Entzündungsreaktion hemmen und ein günstiges Mikroumfeld für Gewebereparatur schaffen könnte. Dies deutet darauf hin, dass KPV die Überaktivierung von Entzündungsreaktionen hemmen kann, indem es entzündungsbedingte Signalwege reguliert und so ein günstiges Mikroumfeld für Gewebereparatur schafft. So wird beispielsweise während der Entzündung der intrazelluläre NF-κB-Signalweg häufig aktiviert, was zur Transkription und Expression von Entzündungsfaktoren führt, und KPV kann die Produktion von Entzündungsfaktoren reduzieren, indem es die Aktivierung des NF-κB-Signalwegs hemmt, wodurch der durch Entzündung verursachte Schaden reduziert wird [2].
Bei der Reparatur der Darmschleimhaut reguliert PMSP - KPV die Darmflora und erhöht die Häufigkeit nützlicher Mikroorganismen. Bei der Hautgewebereparatur verbessern KPV-modifizierte Liposomen die zelluläre Mikroumgebung, indem sie gezielt an den Melanocortinrezeptor-1 (MC1R) binden, der es flexiblen Liposomen ermöglicht, sich in der Nähe von Melanozyten in der Basalschicht zu verankern und zu aggregieren.48 Eine geeignete zelluläre Mikroumgebung ist für die Gewebereparatur unerlässlich. KPV bietet günstige Bedingungen für die Gewebereparatur, indem sie die mikrobielle Zusammensetzung oder Zell-Cell-Interaktionen in der zellulären Mikroumgebung reguliert [4].
KPV weist verschiedene potenzielle Anwendungen im biomedizinischen Bereich auf und wird voraussichtlich eine wichtige Rolle bei der Behandlung weiterer Krankheiten spielen, mit einem tieferen Verständnis seines Wirkmechanismus und der kontinuierlichen Entwicklung verwandter Technologien.
Artikelautor
Die oben genannte Literatur wurde von Dr. Velira Nyssén recherchiert, redigiert und organisiert.
Autor wissenschaftlicher Zeitschrift
Dr. Ying-Zheng Zhao von der Fakultät für Pharmazeutische Wissenschaften der Wenzhou Medical University in China verfügt über ein umfangreiches akademisches Netzwerk. Er arbeitet mit verschiedenen renommierten Institutionen wie der Xinxiang Medical University, der North China University of Science & Technology sowie internationalen wie der University of Louisville und der Drexel University zusammen. Seine Partnerschaften erstrecken sich auch auf Forschungszentren und Unternehmen und zeigen seinen interdisziplinären Ansatz.
Dr. Zhaos Forschung umfasst Pharmakologie und Pharmazie, Materialwissenschaften, Chemie und Ingenieurwesen sowie weitere interdisziplinäre technische Themen. Durch die Integration dieser Felder treibt er Innovationen sowohl in Forschung als auch in Anwendungen voran. Mit seinem kooperativen Geist und seinem Engagement für Exzellenz bleibt er ein bedeutender Beitrag zum wissenschaftlichen Fortschritt und zur akademisch-industriellen Kooperation.
Zitate Quellenangaben
[1]. Xiao B, Xu Z, Viennois E, Zhang Y, Zhang Z, Zhang M, Han MK, Kang Y, Merlin D. Die orale gezielte Abgabe von Tripeptid KPV über hyaluronsäurefunktionalisierte Nanopartikel lindert die Colitis ulcerosa effizient. MOL THER. [Fachartikel]. 2017 2017-07-05; 25(7):1628-40.10.1016/j.ymthe.2016.11.020
[2]. Shao W, Chen R, Lin G, Ran K, Zhang Y, Yang J, Pan H, Shangguan J, Zhao Y, Xu H. In situ mukoadistisches Hydrogel, das Tripeptid KPV einfängt: die entzündungshemmende, antibakterielle und reparierende Wirkung auf die durch Chemotherapie induzierte orale Schleimhautentzündung. BIOMATER SCI-UK. [Fachartikel]. 2021 2021-12-21; 10(1):227-42.10.1039/d1bm01466h
[3]. Dalmasso G, Charrier-Hisamuddin L, Nguyen HTT, Yan Y, Sitaraman S, Merlin D. Die von PepT1 vermittelte Tripeptid-KPV-Aufnahme reduziert die Darmentzündung. GASTROENTEROLOGIE. [Fachartikel; Forschungsunterstützung, N.I.H., Extramural]. 2008 2008-01-01; 134(1):166-78.10.1053/j.gastro.2007.10.026
[4]. Zhao Y, Xue P, Lin G, Tong M, Yang J, Zhang Y, Ran K, Zhuge D, Yao Q, Xu H. Ein KPV-bindendes Doppelnetzwerk-Hydrogel stellt die Darmschleimhaut in einem entzündeten Dickdarm wieder her. ACTA BIOMATER. [Fachartikel; Forschungsunterstützung, Nicht-US-amerikanische Gov't]. 2022 2022-04-15; 143:233-52.10.1016/j.actbio.2022.02.039
ALLE ARTIKEL UND PRODUKTINFORMATIONEN AUF DIESER WEBSITE DIENEN AUSSCHLIESSLICH ALS REFERENZ UND ZU BILDUNGSZWECKEN.
Die angebotenen Produkte sind streng für die In-vitro-Forschung vorgesehen (vom Latein: "in Glas"), was sich auf Studien außerhalb lebender Organismen bezieht. Diese Substanzen stellen keine pharmazeutischen Medikamente dar und wurden nicht von der US-amerikanischen Food and Drug Administration (FDA) zur Prävention, Behandlung oder Heilung von medizinischen Erkrankungen, Krankheiten oder Störungen geprüft oder zugelassen. Nach gesetzlichen Bestimmungen ist jegliche Einführung dieser Produkte in menschliche oder tierische biologische Systeme, unabhängig von der Verabreichungsmethode, ausdrücklich verboten.