LL-37 ist das einzige antimikrobielle Peptid (Antimikrobielle-Peptid, AMP) im menschlichen Körper, das zur Familie der Cathelicidin gehört, die aus 37 Aminosäuren besteht und seinen Namen von den beiden Leucinen ableitet, die am N-Terminus (L-L) beginnen. Als Kerneffektormolekül des angeborenen Immunsystems besitzt LL-37 nicht nur eine breite antimikrobielle Aktivität im breiten Spektrum, sondern ist auch an komplexen biologischen Prozessen wie Immunregulation, Modulation der Entzündungsreaktion und Gewebereparatur beteiligt. In den letzten Jahren wurde festgestellt, dass LL-37 eine wichtige Rolle bei Infektionskrankheiten, Tumoren, neurodegenerativen Erkrankungen und Autoimmunerkrankungen spielt, und seine doppelten Funktionen (entzündungsfördernd und entzündungshemmend, krebsfördernd und krebshemmend wirken) haben es zu einem Hotspot für Forschung in vielen Fachgebieten gemacht.
Was ist LL-37?
LL-37 gehört zur antimikrobiellen Peptidfamilie der Wirtsabwehrpeptide und ist das einzige kathelizidische antimikrobielle Peptid im menschlichen Körper. Es ist das einzige antimikrobielle Peptid mit Cathelicidin im menschlichen Körper. Es wurde erstmals 1980 vom schwedischen Wissenschaftler Boman H G in der Puppe der Seidenraupe entdeckt und nach der Entdeckung einer Klasse kationischer Peptide, die pathogene Bakterien abtöten, als antimikrobielles Peptid bezeichnet. Nach einer Reihe von Verarbeitungen bildet es ein kationisches Peptid mit 37 Aminosäureresten und einer relativen Molekularmasse von etwa 4,5 kD.
LL-37-Struktur
LL-37-Forschung
Antibakterielle Wirkung von LL-37
Auswirkungen auf grampositive Bakterien: In der Studie gegen Staphylococcus aureus wurde festgestellt, dass LL - 37 eine starke in vitro antibakterielle Wirkung aufwies, mit einer minimalen inhibitorischen Konzentration (MIC) von etwa 0,62 μΜ. Darüber hinaus hatte LL-37 einen signifikanten Einfluss auf die Haftung von S. aureus bei Konzentrationen ≥ 0,16 μM; ein signifikanter anti-staphylokokkaler Biofilmeffekt auf ein statisches Biofilmmodell bei Konzentrationen von 0,31 - 10 μM; und einen erheblichen störenden Effekt auf S. aureus-Biofilme, die auf Titanlegierungsoberflächen durch 5 μM LL - 37 gebildet werden [1].
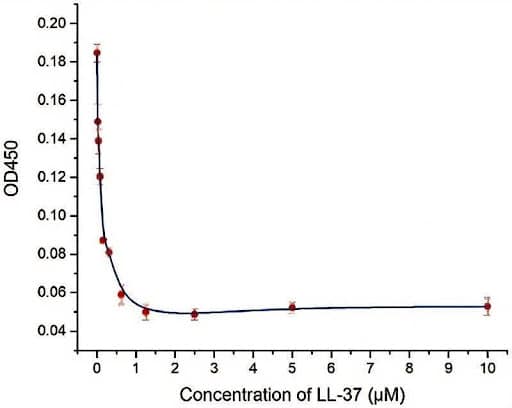
Abb. 1. Hemmungskurve von LL-37 gegen S. aureus. An jeder Konzentration wurden drei Replikate durchgeführt, und die Ergebnisse wurden als Mittelwert ± Standardabweichung angegeben.
Quelle: PudMed [1]
Maßnahmen gegen gramnegative Bakterien: LL-37 zeigte außerdem antibakterielle Aktivität gegen E. coli. Die Studie entwarf das Antikrebsderivat von LL - 37, P38, so dass es eine höhere bakterizide Aktivität gegen multiresistente (MDR) klinische Isolate von E. coli aufweist als P7 und P22; P38 tötet E. coli durch Störung der bakteriellen Zellmembran, und molekulare Docking-Studien zeigten, dass P38 eine höhere Affinität zur äußeren Membran von gramnegativen Bakterien aufweist[2]. Außerdem zeigte LL-37 signifikante Auswirkungen auf multiresistente Pseudomonas aeruginosa, die aus Verbrennungsinfektionen isoliert wurde, mit einem Konzentrationsbereich von 15,6 bis 1000 μg/ml, was einen signifikanten Einfluss auf das Wachstum von Pseudomonas aeruginosa bei niedrigen Konzentrationen hatte [3].
Viele Studien haben gezeigt, dass die Störung bakterieller Zellmembranen durch LL-37 und seine Derivate einer seiner wichtigen antimikrobiellen Mechanismen ist. Als Beispiel wurde durch eine Feldemissions-Rasterelektronenmikroskopie (FE - SEM) beobachtet, dass P38 in der Lage war, die Zellmembran von Escherichia coli zu stören, was zu einem Austritt von bakteriellen Inhalten führte, was zum Tod der Bakterien führte. LL-37 kann aufgrund seiner kationischen Eigenschaften mit negativ geladenen Komponenten der bakteriellen Zellmembran interagieren, die Permeabilität der Zellmembran verändern und letztlich den Platzen der Zellmembran verursachen [2].
LL-37 ist auch an der Immunmodulation während des antibakteriellen Prozesses beteiligt. Es kann die Chemotaxis von Immunzellen, die Freisetzung von Zytokinen usw. regulieren, wodurch die Immunabwehr des Körpers gestärkt und indirekt antimikrobielle Effekte entsteht. LL-37 kann Immunzellen wie Neutrophile und Monozyten an die Infektionsstelle ziehen, die entweder direkt phagozytisieren und die Bakterien abtöten oder durch die Freisetzung anderer antimikrobieller Substanzen synergetisch antimikrobiell wirken können. LL-37 reguliert außerdem das entzündungsassoziierte Zytokin LL-37. Kann auch die Expression entzündungsbedingter Zytokine regulieren, etwa die Freisetzung von Interleukin-8 (IL-8) und anderen Chemokinen zur Steuerung der Aggregation von Immunzellen, sowie die Regulierung der Produktion von Entzündungsfaktoren wie dem Tumornekrosefaktor-alpha (TNF-alpha), das Ausgleich der Entzündungsreaktionen, die Vermeidung von übermäßiger Entzündung und Körperschäden. und ein günstiges internes Umfeld für antimikrobielle Aktivität zu schaffen.
Krebshemmende Wirkung von LL-37 auf verschiedene Krebszellen
Dualität von pro-krebs- und antikarzinogenen Effekten bei Eierstockkrebs, Lungenkrebs und anderen Tumoren: Es wurde festgestellt, dass LL-37 eine pro-krebsartige Rolle bei Eierstockkrebs, Lungenkrebs, bösartigem Melanom, Plattenepithelkarzinom der Haut und Prostatakrebs spielen kann sowie eine antikarzinogene Rolle bei Magentumoren, Darmkrebs, Leukämie und anderen Tumoren. Solch unterschiedliche Effekte bei verschiedenen Tumoren deuten darauf hin, dass die Auswirkungen von LL-37 auf Tumore komplex sind und mit verschiedenen Faktoren wie der Mikroumgebung und dem Zelltyp zusammenhängen können.
Hemmende Wirkung auf Darmkrebs: Die Studie zur Konstruktion von HT-29-Zellen von LL-37-Überexpressionskrebs und zur Entwicklung eines Mausmodells von Darmkrebs zeigte, dass im Vergleich zur Kontrollgruppe und der leeren Gruppe die Expressionsniveaus von LL-37-mRNA und -protein in den HT-29-Zellen von Mäusen der LL-37-Überexpressionsgruppe signifikant erhöht waren. Während Tumormasse und -volumen signifikant reduziert waren, erhöhte sich die Tumorhemmungsrate und die Apoptose der Tumorzellen wurde reduziert. Dies beweist direkt, dass die Expression von LL-37-mRNA und Proteinen in HT-29-Zellen signifikant erhöht war. Dies zeigt direkt, dass LL-37 das Tumorwachstum in Darmkrebsmodellen hemmen kann.
Mögliche Auswirkungen auf Brustkrebs: Studien zur Antitumoraktivität neuartiger LL-37-Heteropeptide an Brustkrebs-MCF-7-Zellen, obwohl die spezifischen Mechanismen nicht näher erläutert wurden, deuten darauf hin, dass LL-37-verwandte Heteropeptide potenziellen Forschungswert in der Brustkrebsbehandlung haben [4].
Induktion der Apoptose: Bei Darmkrebs kann LL - 37 das Fortschreiten des Darmkrebses behindern, indem es eine caspaseunabhängige Apoptose auslöst. Apoptose ist eine Form des programmierten Zelltodes, und unter normalen Bedingungen halten intrazelluläre Apoptose-Regulationsmechanismen das Gleichgewicht zwischen Leben und Tod der Zellen aufrecht. Tumorzellen haben oft die Eigenschaft, Apoptose zu umgehen, und LL-37 ist in der Lage, den klassischen, caspaseabhängigen apoptotischen Weg zu umgehen und andere apoptotische Mechanismen zu aktivieren, die zum Absterben von Darmkrebszellen beitragen und so das Tumorwachstum hemmen [5].
Regulierung des Tumormikroumfelds: Das Tumormikromilieu ist entscheidend für Tumorwachstum, Metastasen und Immunflucht, und LL-37 kann das Tumormikromilieu auf verschiedene Weise regulieren, um antikrebswirksame Wirkung zu erzielen. Beispielsweise verbessert LL-37 in Magenkrebszellen die Tumorsuppressor-Knochenmorphogenetische Protein-Signalübertragung, indem es das Proteasom einschränkt. Der knochenmorphogenetische Protein-Signalweg spielt eine Schlüsselrolle bei der Zellproliferation, Differenzierung und Apoptose, und die Regulation dieses Weges durch LL-37 kann das biologische Verhalten von Magenkrebszellen beeinflussen und somit die Tumorentwicklung hemmen.
Aktivierung des Signalwegs zur Förderung der Zellautophagie: In einem Mausmodell von Darmkrebs aktivierte LL-37 den AMPK/mTOR-Signalweg, um die Zellautophagie zu fördern, was wiederum das Wachstum von Tumoren bei HT-29-Mäusen mit Darmkrebs hemmte. Der AMPK/mTOR-Signalweg ist ein wichtiger Weg zur Regulierung von Energie und Wachstum in Zellen. AMPK ist ein wichtiger, energie- und wachstumsregulierender Weg in der Zelle. Wenn die Zelle unter Energiemangel oder Stress steht, wird AMPK aktiviert, was wiederum mTOR hemmt und die Autophagie in der Zelle auslöst. Autophagie ist ein intrazellulärer Selbstabbauprozess, der die Stabilität der intrazellulären Umgebung aufrechterhält, indem beschädigte Organellen und Proteine entfernt werden. In Tumorzellen kann moderate Autophagie das Tumorwachstum hemmen. LL-37 fördert das Auftreten von Autophagie in Tumorzellen, indem es diesen Signalweg aktiviert und so den Zweck der Tumorsuppression erreicht.
Beeinflusst die Proliferation und das Überleben von Tumorzellen: Insgesamt kann LL-37 seine krebswirksamen Effekte ausüben, indem es direkt die Proliferation und das Überleben von Tumorzellen beeinflusst. LL-37 und seine Fragmente und Analoga haben gezeigt, dass sie das Wachstum von Tumorzellen in verschiedenen Tumorzelllinien hemmen, und es wird vermutet, dass sie die Regulation des Zellzyklus, die DNA-Synthese oder andere biologische Prozesse, die eng mit Zellproliferation und Überleben verbunden sind, beeinträchtigen könnten. Beispielsweise beeinflussen sie durch die Bindung an bestimmte Rezeptoren auf der Oberfläche von Tumorzellen oder das Eindringen in die Zelle, um mit verwandten Molekülen zu interagieren, die Expression oder Aktivität von Zellzyklusproteinen, wodurch Tumorzellen in bestimmten Stadien des Zellzyklus stagnieren und keine normale Proliferation und Teilung durchlaufen, was letztlich zum Absterben der Tumorzellen führt [5].
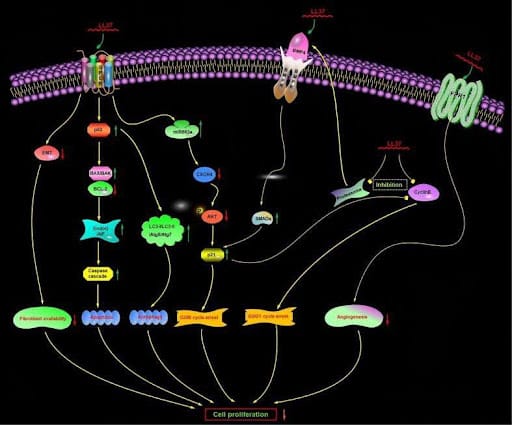
Abb. 2. Vorgeschlagener nicht-membranolytischer anticancerartiger Mechanismus des humanen Cathelicidins LL-37. Die Hemmung der Proteasomenaktivität induziert die Hochregulation von BMP4, was wiederum die BMP-Signalübertragung aktiviert. GPCR, G-Protein-gekoppelter Rezeptor; CXCR4, CXC Chemokinrezeptor Typ 4; EndoG, Endonuklease G; AIF, Apoptose-induzierender Faktor; FPR1, Formylpeptidrezeptor 1. BMP4, knochenmorphogenetisches Protein 4; BMPR, Knochenmorphogenetischer Proteinrezeptor.
Quelle: PudMed [6]
Wirkung von LL-37 auf die Zellproliferation
Förderung der Proliferation von Fibroblasten: LL-37 fördert die Proliferation von Fibroblasten im Prozess der Wundreparatur der Haut. So konnten beispielsweise LL-37 und sein abgeleitetes Peptid LL-37R in der Untersuchung der diabetischen Wundheilung die Schäden an NIH/3T3 von embryonalen Mausfibroblasten durch das hohe Glukose-Umfeld lindern und die Zellproliferation fördern. Während die hohe Glukoseumgebung die normale Funktion der Fibroblasten hemmt, kann LL-37 die Proliferation von Fibroblasten fördern und die Wundheilung beschleunigen, indem es intrazelluläre Signalwege reguliert, wie etwa die Aktivierung des PI3K/Akt-Signalwegs, der eine Schlüsselrolle für das Überleben, die Proliferation und den Stoffwechsel von Zellen spielt.
Förderung der Proliferation von Gefäßendothelzellen: Angiogenese ist ein wichtiger Bestandteil der Gewebereparatur, und LL-37 hat ebenfalls einen positiven Effekt auf die Proliferation von Gefäßendothelzellen. In vitro wurde festgestellt, dass LL-37 die Proliferation menschlicher Nabelvenendothelzellen (HUVECs) fördert. Der Mechanismus könnte mit der Hochregulation der Expression des vaskulären endothelialen Wachstumsfaktors (VEGF) und seines Rezeptors zusammenhängen, der ein Schlüsselbestandteil der Proliferation der vaskulären Endothelzellen ist.
Auswirkungen von LL-37 auf die Zellmigration
Steuerung der Migration von Fibroblasten: Während des Wundheilungsprozesses müssen Fibroblasten zur Wundstelle wandern, um Reparaturarbeiten durchzuführen; LL-37 kann die Migration der Fibroblasten zur Wundstelle lenken. Forschungen zeigen, dass LL-37 an Chemokinrezeptoren auf der Oberfläche von Fibroblasten binden kann, intrazelluläre Signalübertragungen wie die Aktivierung der Src-Kinase aktivieren und dann die zytoskelettale Umordnung regulieren kann, damit Fibroblasten entlang des Konzentrationsgradienten zur Wunde wandern und an der Wundreparatur teilnehmen können.
Förderung der Migration von vaskulären Endothelzellen: Ebenso kann LL-37 die Migration der vaskulären Endothelzellen fördern. Im Prozess der Angiogenese ist die Migration der Endothelzellen ein wichtiger Schritt bei der Bildung eines neuen Blutgefäßnetzes. LL-37 kann Matrix-Metalloproteinasen (MMPs) aktivieren, die extrazelluläre Matrix abbauen, um Platz für die Migration der Endothelzellen zu schaffen, und gleichzeitig die Adhäsion zwischen den Zellen und der extrazellulären Matrix regulieren, damit die Endothelzellen reibungslos zu den angiogenen Stellen wandern können, und die vaskuläre Neovaskularisation fördern.
LL-37 spielt eine wichtige Rolle bei der Gewebereparatur, indem es die Gewebereparatur und -regeneration fördert, indem es Zellproliferation, Migration, Entzündungsreaktion und Zelldifferenzierung reguliert. Die eingehende Untersuchung ihres Wirkmechanismus bildet eine theoretische Grundlage für die Weiterentwicklung von LL-37-basierten therapeutischen Strategien zur Gewebereparatur. In Zukunft wird erwartet, dass die Forschung die Eigenschaften von LL-37 besser nutzen wird, um die Wirkung der Gewebereparatur zu verbessern und neue Ideen und Methoden für die klinische Behandlung bereitzustellen.
Artikelautor
Die oben genannte Literatur wurde von Dr. Velira Nyssén recherchiert, redigiert und organisiert.
Autor wissenschaftlicher Zeitschrift
Hossein Aghazadeh (Aghazadeh, Hossein) ist ein angesehener Forscher, der mit bedeutenden akademischen und Forschungseinrichtungen im Iran verbunden ist. Er ist mit dem Pasteur-Institut des Iran, einem führenden Zentrum für biomedizinische Forschung, sowie mit der Shahid Beheshti University Medical Sciences und der Islamic Azad University verbunden, wo er zu akademischen und wissenschaftlichen Projekten in verschiedenen Disziplinen beiträgt.
Seine Forschungsinteressen umfassen ein breites interdisziplinäres Spektrum und umfassen Biochemie und Molekularbiologie, Infektionskrankheiten und Mikrobiologie – Bereiche, die zentral für das Verständnis biologischer Mechanismen und die Bekämpfung pathogener Bedrohungen sind. Darüber hinaus engagiert er sich für Informatik und Biophysik und integriert rechnergestützte Ansätze und physikalische Prinzipien, um komplexe biologische Fragestellungen zu beantworten. Dieser interdisziplinäre Fokus unterstreicht seine Fähigkeit, theoretisches Wissen mit angewandter Forschung zu verbinden und so Innovationen an der Schnittstelle von Lebenswissenschaften und quantitativen Methoden voranzutreiben.
Durch seine Verbindungen und Forschungstätigkeiten leistet Aghazadeh weiterhin bedeutende Beiträge zum wissenschaftlichen Fortschritt, insbesondere in Bereichen, die für die menschliche Gesundheit und das biologische Verständnis entscheidend sind.
Zitate Quellenangaben
[1]. Wei J, Cao X, Qian J, Liu Z, Wang X, Su Q, Wang Y, Xie R, Li X. Bewertung des antimikrobiellen Peptides LL-37 zur Behandlung des Biofilms von Staphylococcus aureus auf Titanplatte. MEDIZIN. [Fachartikel]. 2021 2021-11-05; 100(44):e27426.10.1097/MD.000000000027426
[2]. Aghazadeh H, Memariani H, Ranjbar R, Pooshang Bagheri K. Die Aktivität und der Wirkmechanismus neuartiger kurzer, selektiver LL-37-abgeleiteter Antikrebspeptide gegen klinische Isolate von Escherichia coli. CHEM BIOL DRUG DES. [Fachartikel]. 2019 2019-01-01; 93(1):75-83.10.1111/cbdd.13381
[3]. AL-Sabagh FSH, Ghaima KK, AL-Dabbagh AHS. Die antibakterielle Aktivität des LL-37-Peptids gegen multiresistente Pseudomonas aeruginosa, isoliert aus Verbrennungsinfektionen. Bionatura. 2023. https://api.semanticscholar.org/CorpusID:257935276
[4]. Chen X, Li L, He S, Min Z. Anti-Tumor-Wirkung des neuen LL-37 hybriden antimikrobiellen Peptids auf Brustkrebs-MCF-7-Zellen. In: Herausgeber, Herausgeber; 2020. Pub Place; 2020. https://api.semanticscholar.org/CorpusID:221697378
[5]. Ahmad A, Fawaz MAM. Der krebshemmende Mechanismus des humanen antimikrobiellen Peptids LL-37. NeuroPharmac Zeitschrift. 2021 https://api.semanticscholar.org/CorpusID:245733453
[6]. Lu F, Zhu Y, Zhang G, Liu Z. Renovierung als Innovation: Umnutzung des humanen antibakteriellen Peptids LL-37 für die Krebstherapie. VORDERE PHARMACOL. [Fachartikel; Rezension]. 2022 2022-01-20; 13:944147.10.3389/fphar.2022.944147
ALLE ARTIKEL UND PRODUKTINFORMATIONEN AUF DIESER WEBSITE DIENEN AUSSCHLIESSLICH ALS REFERENZ UND ZU BILDUNGSZWECKEN.
Die angebotenen Produkte sind streng für die In-vitro-Forschung vorgesehen (vom Latein: "in Glas"), was sich auf Studien außerhalb lebender Organismen bezieht. Diese Substanzen stellen keine pharmazeutischen Medikamente dar und wurden nicht von der US-amerikanischen Food and Drug Administration (FDA) zur Prävention, Behandlung oder Heilung von medizinischen Erkrankungen, Krankheiten oder Störungen geprüft oder zugelassen. Nach gesetzlichen Bestimmungen ist jegliche Einführung dieser Produkte in menschliche oder tierische biologische Systeme, unabhängig von der Verabreichungsmethode, ausdrücklich verboten.