MOTS-c ist ein mitochondrienabgeleitetes Peptid, das von mitochondrialer 12S-rRNA codiert wird und aus 16 Aminosäuren besteht. Als neues Mitglied der MDPs-Familie wird es aus dem kurzen offenen Leserahmen des mitochondrialen Genoms transkribiert. MOTS-c kann autokrin und parakrin wirken und ist weit verbreitet in verschiedenen Geweben wie Skelettmuskulatur, Herzmuskel, Serum und Fett. Studien haben die Rolle von Mots-c bei der Förderung der metabolischen Homöostase, der Verlangsamung des Alterns, der Verbesserung der Bewegungskapazität und der Wirksamkeit bei der Behandlung von Diabetes mellitus nachgewiesen.
Was ist Mots-C?
MOTS-c ist ein mitochondrien-abgeleitetes Peptid, das aus 16 Aminosäuren besteht, die von der 12S-rRNA-Region des mitochondrialen Genoms codiert werden. Das MOTS-c-Protein translokiert während metabolischem Stress in den Kern und lenkt die Expression der Kerngene, um die zelluläre Homöostase zu fördern. Verschiedene Gewebe exprimieren das Protein mit Mitochondrien, und Plasma enthält das Protein ebenfalls, aber sein Spiegel nimmt mit dem Alter ab. Darüber hinaus wurde gezeigt, dass MOTS-c den Glukosestoffwechsel in der Skelettmuskulatur verbessert, was darauf hindeutet, dass es bei Krankheiten wie Diabetes, Fettleibigkeit und Alterung vorteilhaft ist.
Die GHK-Cu-Struktur
Mots-C-Forschung
MOTS-c Tätigkeit in verschiedenen Organisationen
Muskelgewebe: Im Muskelgewebe ist MOTS-c wichtig für die Differenzierung von Muskelvorläuferzellen. Es wurde gezeigt, dass das Wildtyp-MOTS-c-Peptid die Myotubenbildung erhöht, das Y8F-mutanten-Peptid jedoch nicht in humanen (LHCN-M2) und Maus-(C2C12) Muskelvorläuferzellmodellen. Es wurde außerdem festgestellt, dass MOTS-c Wildtyp interagierte mit dem IL-6/Janus-Kinase/Signaltransducer und Aktivator des Transkriptions-3-(STAT3)-Weges, um die IL-6-induzierte Abnahme der nukleären Myogenese-Färbung in Myoblasten zu hemmen. Konkret interagiert MOTS-c mit STAT3 über ein mutmaßliches Src-Homologie-2 (SH2)-Bindungsmotiv in der YIFY-Region, reduziert die transkriptionelle Aktivität von STAT3 und verbessert dadurch die Myotubebildung. Dieser Mechanismus bietet eine mögliche therapeutische Richtung zur Bekämpfung von Muskelatrophie bei bestimmten Krankheiten [1].
Quelle: ELSEVIER [1]
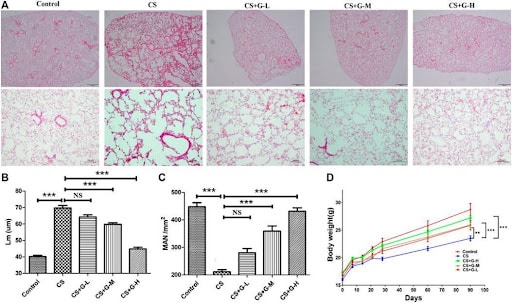
Lungengewebe: Im Lungengewebe, MOTS-c dämpft die Strahlenpneumonitis (RP) hauptsächlich durch den Schutz der mitochondrialen Funktion. Strahlenpneumonitis wird hauptsächlich durch mitochondriale Schäden an Lungenepithelzellen und MOTS verursacht-C schützt vor einer Vielzahl von Krankheiten. Tägliche intraperitoneale Injektion von MOTS-c für 2 Wochen bei C57BL/6 Mäusen, die 20 Gy Lungenbestrahlung ausgesetzt waren, zeigten, dass MOT-c Verbesserte signifikant strahleninduzierte Lungengewebeschädigungen, Entzündungen und oxidativen Stress, während Apoptose und mitochondriale Schäden in alveolaren Epithelzellen von Mäusen mit Strahlenpneumonitis rückgängig gemacht wurden und außerdem oxidativen Stress und mitochondriale Schäden in Lungenepithelzellen der MLE signifikant gehemmt wurden-12 Zellen und Primärmäuse. Mitochondrienschäden. Der Wirkmechanismus besteht darin, dass MOTS-c das Niveau des nuklearfaktor-E2-bezogenen Faktors (Nrf2) erhöht und dessen Translokation in den Zellkern fördert. Darüber hinaus eliminiert der Nrf2-Mangel die Schutzfunktion von MOTS-c bei Mäusen mit Strahlenpneumonitis, was darauf hindeutet, dass MOTS-c die Strahlenpneumonitis durch einen Nrf2-abhängigen Mechanismus abschwächt [2].
Stoffwechselbezogene Gewebe: MOTS-C spielt eine wichtige regulatorische Rolle im Lipidstoffwechsel. Es erhöht die Thermogenese von braunem Fett (BAT) und fördert die Bräunung des weißen Fetts (WAT), passt sich so an kalte Umgebungen an und verhindert Fettleibigkeit sowie Störungen des Lipidstoffwechsels. In Mausexperimenten wurde Behandlung von Mäusen mit MOT behandelt-c erhöhte die Aktivierung von braunem Fett, verringerte die durch OVX (OVX)-induzierte Fettansammlung und die entzündliche Infiltration im weißen Fettgewebe sowie verringerte Fettsäurewerte in Serum und Leber. Das deutet darauf hin, dass ein MOT ist-c beeinflusst den Fettstoffwechsel und die Energiehomöostase, indem es die Funktion des Fettgewebes reguliert [3] .
Die Knochenhomöostase umfasst Knochenbildung und Knochenresorption, vermittelt durch Osteoblasten und Osteoklasten sowie MOT-C reguliert die Aktivität von Osteoblasten und Osteoklasten. Neuere Studien haben gezeigt, dass es die Vermehrung, Differenzierung und Mineralisierung von Osteoblasten fördert. Osteoblasten sind verantwortlich für die Synthese, Sekretion und Mineralisierung der Knochenmatrix. MOTS-c kann die Expression osteogenese-bezogener Gene wie Osteocalcin (OCN) und alkalische Phosphatase (ALP) fördern, indem es die relevanten Signalwege in Osteoblasten reguliert, was wiederum die Funktion der Osteoblasten verbessert und die Knochenbildung fördert. Während Osteoklasten hauptsächlich für die Knochenresorption verantwortlich sind, kann MOTS-c die Knochenresorption hemmen, indem es osteoklastbedingte Differenzierungsfaktoren, wie etwa die durch den Osteoklasten induzierte Differenzierung des nuklearen Faktor-κB-Rezeptor-Faktor-Ligands (RANKL)-induzierte, hemmt und die Anzahl und Aktivität der Osteoklasten verringert. Durch diese doppelte Wirkung entsteht MOTS-C beteiligt sich an der Regulation des Knochenstoffwechsels und der Knochenremodellierung und erhält die normale Struktur und Funktion des Skeletts aufrechterhalten [4].
MOTS-c kann den Alterungsprozess verlangsamen.
Studien haben gezeigt, dass MOTS-C kolokalisiert mit Mitochondrien in verschiedenen Geweben und wird auch im Plasma nachgewiesen, wobei seine Spiegel mit dem Alter abnimmt. Zum Beispiel bei gesunden älteren Männern zirkulierende MOTS-c nimmt mit dem Alter ab, aber die Expression von MOT-C im Skelettmuskel ist bei älteren (70) etwa 1,5-fach höher-81 Jahre alt) und mittleren Alters (45-55 Jahre alt) Männer als in jüngeren (18 Jahre)-30 Jahre alt) Männer, was darauf hindeutet, dass Plasma und Muskelexpression von MOTS-c zeigen unterschiedliche Regulationsmuster während des Alterns [5].
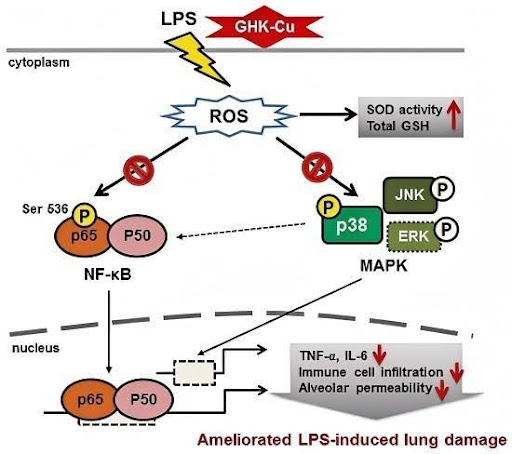
Abb. 2. Die Plasmaspiegel von MOTS-c sinken und die Skelettmuskulatur steigt mit dem Alter. Plasma-MOTS-c (A) korreliert mit der Expression von HOMA-IR (B), Fettmasse (C), magerer Masse (D) und Muskel-MOTS-c (E) bei jungen, mittelalten und älteren Männern. Repräsentative Blots sind unabhängig und von verschiedenen Teilnehmern. Korrelation zwischen Plasma-MOTS-c und Muskel-MOTS-c-Expression bei jungen (F), mittleren (G) und kombinierten (H). Die Signifikanz wurde mittels linearer Regression oder Einweg-ANOVA bestimmt. Die Daten werden als Mittelwerte ± SE, n=26 pro Gruppe, präsentiert, mit Ausnahme von Körperzusammensetzungsmessungen, bei denen für einen jungen (n=25) und mittelalten (n=25) Teilnehmer keine Daten vorlagen. *p<0,05, **p<0,01, ***p<0,001.
Quelle: PubMed [5]
Es wurde gezeigt, dass MOTS-c positive Effekte auf altersbedingte Erkrankungen wie Diabetes, Herz-Kreislauf-Erkrankungen, Osteoporose, postmenopausale Fettleibigkeit und Alzheimer hat. Alterung ist gekennzeichnet durch einen allmählichen Verlust der mitochondrialen metabolischen Homöostase, einen Rückgang der Muskelhomöostase und letztlich einen Rückgang der körperlichen Leistungsfähigkeiten, und die Behandlung mit MOTS-c hält Versprechen, diese Änderungen rückgängig zu machen [6].
MOTS-c handelt hauptsächlich durch das Folat-AICAR-AMPK-Pfad. MOTS-Die c-Expression steigt in Zeiten mit geringer zellulärer Energie, wie etwa bei Sport oder Stress. Sie aktiviert die AMP-aktivierte Proteinkinase (AMPK), indem sie den intrazellulären Folatzyklus und die Purin-Nukleotid-ab initio-Synthese hemmt, und AMPK, als wichtiger Regulator des zellulären Energiestoffwechsels, phosphoryliert verschiedene nachgelagerte Zielproteine, reguliert Prozesse wie Glukose- und Lipidstoffwechsel, erhöht die Energieproduktion, verbessert die Effizienz der zellulären Energieversorgung und erhält die zelluläre Energiehomöostase aufrecht. wodurch der Alterungsprozess verlangsamt wird. Zum Beispiel sind in altersbildenden MSCs MOTs-c kann AMPK signifikant aktivieren, die Zellmorphologie-Wiederherstellung fördern und die zelluläre Homöostase verbessern [7].
Insulinresistenz ist eine der häufigsten Stoffwechselerkrankungen im Alter und steht in engem Zusammenhang mit vielen altersbedingten Erkrankungen. MOTS-c reguliert den Insulinsignalweg und erhöht die Insulinsensitivität durch die Aktivierung von AMPK, verbessert die zelluläre Aufnahme und Nutzung von Glukose und reduziert Zellschäden durch erhöhte Glukose, wodurch der Rückgang der mit dem Alter verbundenen Stoffwechselfunktionen verlangsamt wird.
Während des Alterns führt die mitochondriale Dysfunktion zu einem abnormalen Sauerstoffverbrauch und einer erhöhten Erzeugung reaktiver Sauerstoffspezies (ROS), und die ROS-Ansammlung schädigt zelluläre Biomoleküle und beschleunigt das Altern. MOTS-c kann den Sauerstoffverbrauch und die ROS-Bildung senken, indem es die mitochondriale Homöostase verbessert. Bei alternden menschlichen MSCs reduzierte die Behandlung mit MOTS-C den Sauerstoffverbrauch und die ROS-Produktion signifikant, wodurch der mitochondriale Zustand dem jungen Zellen näher kam, wodurch die Zellen vor oxidativem Stress geschützt und das Altern verlangsamt wurden [7].
Chronische Entzündungen sind eines der wichtigen Merkmale des Alterns und stehen in engem Zusammenhang mit der Entwicklung vieler altersbedingter Krankheiten. MOTS-c kann systemische chronische Entzündungen reduzieren, indem es den entzündlichen Signalweg hemmt und die Expression sowie Freisetzung von Entzündungsfaktoren reduziert. So reduzierte beispielsweise in einigen Entzündungsmodellen die Behandlung mit MOTS-c signifikant die Spiegel entzündungsbedingter Zytokine, linderte die Schäden an Gewebezellen und half, den Alterungsprozess zu verlangsamen. Der spezifische Mechanismus könnte damit zusammenhängen, dass MOTS-c die Aktivität von Schlüsselmolekülen des entzündlichen Signalwegs wie dem nuklearen Transkriptionsfaktor κB (NF-κB) reguliert.
MOTS-c Positive Auswirkungen auf die sportliche Leistungsfähigkeit
Studien haben gezeigt, dass langfristige regelmäßige Bewegung zu einem signifikanten Anstieg des MOTS führen kann-C-Protein-Expression in der Skelettmuskulatur. Zum Beispiel 4-8 Wochen freiwilliges Laufen mit erhöhtem MOT-C-Proteinexpression im Mittelfußknochen, medialen Gastrocnemius und Tibialis anterior Muskeln von Nagetieren um etwa 1,5-5-fach im Vergleich zu sitzenden Kontrollen, und dieser Anstieg wurde 4 % beibehalten-6 Wochen nach Ende des Trainings. Gleichzeitig erhöhte eine einzelne Injektion von 15 mg/kg MOTS-c an untrainierte Mäuse deren Gesamtlaufzeit um 12 % und die Distanz um 15 % in einem akuten Belastungstest. Das deutet darauf hin, dass ein MOT ist-c verbessert die Ausdauerleistung positiv, sowohl während adaptiver Veränderungen, die durch langanhaltendes Training ausgelöst werden, als auch in akuten Belastungsszenarien [8] .
In einer Studie zu Myofilmschäden im Skelettmuskel, ausgelöst durch erschöpfende Zentrifugalbewegung, verbesserte die MOTS-c-Ergänzung signifikant die durch Bewegung induzierte intrazelluläre Ansammlung von Evans Blue, den Verlust von Myostatin und den Verlust der Membrankontinuität in Skelettmuskelzellen sowie die Bewegungskapazität bei Mäusen. Das impliziert, dass MOT-C trägt zur Reparatur beschädigter Muskelgewebe nach dem Training bei, was die Erholung nach dem Training fördert und indirekt die allgemeine Trainingskapazität verbessert [8].
Ausdauertraining kann eine phänotypische Verschiebung von schnellen zu langsamen Muskelfasern in der Skelettmuskulatur und MOTS verursachen.-C kann in diesem Prozess eine regulatorische Rolle spielen. Langsame Muskelfasern haben eine höhere aerobe Stoffwechselkapazität und Ermüdungsresistenz, und diese Veränderung trägt zur Verbesserung der Ausdauer im Training bei. Obwohl der genaue Mechanismus noch nicht vollständig verstanden ist, wird angenommen, dass MOTS MOT sind-c kann eine günstige Verschiebung des Muskelfasertyps fördern, indem es relevante Signalwege reguliert und die Expression von Genen beeinflusst, die mit dem Muskelfasertyp verbunden sind, beeinflusst [8].
MOTS-C spielt eine Schlüsselrolle bei der Reparatur von kraftvollen, durch zentrifugalen Belastungen verursachten Myofibrillarmembranschäden in der Skelettmuskulatur. Es erreicht die Membranreparatur, indem es an die Zellmembran bindet und die Verschmelzung intrazellulärer MG53-haltiger Vesikel mit der Zellmembran fördert. Darüber hinaus kann MOTS-c auch an der Regulation der muskelwachstumsbezogenen Signalwege beteiligt sein, indem es die Muskelproteinsynthese fördert, Muskelkraft und -masse steigert und somit die sportliche Leistung steigert [8].
Als mitochondrienabgeleitetes Peptid mit einzigartigen biologischen Eigenschaften und einer breiten Palette physiologischer Funktionen hat MOTS-c großes Potenzial sowohl für die Grundlagenforschung als auch für klinische Anwendungen. Obwohl sich die Untersuchung noch in einem fortgeschrittenen Stadium befindet, verspricht sie mit weiterer Forschung neue Möglichkeiten zur Behandlung einer Vielzahl von Krankheiten und zur Erhaltung der menschlichen Gesundheit zu schaffen.
Artikelautor
Die oben genannte Literatur wurde von Dr. Velira Nyssén recherchiert, redigiert und organisiert.
Autor wissenschaftlicher Zeitschrift
Dr. Yanli Zhang, eine angesehene Forscherin am College of Animal Science and Technology der Nanjing Agricultural University in China, verfügt über ein umfangreiches akademisches Netzwerk und interdisziplinäre Expertise und arbeitet mit zahlreichen renommierten Institutionen im In- und Ausland zusammen – darunter das Zhengzhou University Affiliated Cancer Hospital, das Gansu Provincial Clinical Research Center for Radiological Imaging, die Peking University und die University of California. Davis – um institutionelle Innovation und Wissensaustausch voranzutreiben. Ihre Forschung umfasst das kardiovaskuläre System und die Kardiologie und konzentriert sich auf molekulare Mechanismen von Krankheiten und therapeutische Ziele; Allgemeinmedizin und Innere Medizin, die Grundlagenforschung mit translationalen Ansätzen integriert, um klinische Herausforderungen zu bewältigen; sowie experimentelle Medizin, Zellbiologie und Biochemie, wo sie zelluläre/molekulare Signalwege und Signalwechselwirkungen erforscht. Mit einem starken Schwerpunkt auf interdisziplinärer Zusammenarbeit verbindet ihre Arbeit die Agrarwissenschaft – die an ihrer Hauptinstitution verwurzelt ist – mit medizinischer Forschung und fördert innovative Lösungen, die Tierwissenschaft und menschliche Gesundheit verbinden. Dr. Zhang engagiert sich aktiv in nationalen und internationalen Projekten und ist ein wichtiger Beitragsleister wissenschaftlicher Gemeinschaften und verkörpert Exzellenz bei der Förderung von Fortschritten in der Herz-Kreislauf-Gesundheit, molekularer Medizin und translationaler Wissenschaft durch kollaborative Problemlösung und erstklassige institutionelle Partnerschaften.
Zitate Quellenangaben
[1]. García-Benlloch S, Revert-Ros F, Blesa JR, Alis R. MOTS-c fördert die Muskeldifferenzierung in vitro. PEPTIDE. [Fachartikel]. 2022 2022-09-01; 155:170840.10.1016/j.peptides.2022.170840
[2]. Zhang Y, Huang J, Zhang Y, Jiang F, Li S, He S, Sun J, Chen D, Tong Y, Pang Q, Wu Y. Das mitochondrial abgeleitete Peptid MOTS-c lindert die Strahlenpneumonitis durch einen Nrf2-abhängigen Mechanismus. ANTIOXIDANTIEN-BASEL. 2024; 13
[3]. Lu H, Wei M, Zhai Y, Li Q, Ye Z, Wang L, Luo W, Chen J, Lu Z. Das MOTS-c-Peptid reguliert die fetthaltige Homöostase, um eine durch die Ovariektomie verursachte metabolische Dysfunktion zu verhindern. J MOL MED. [Fachartikel; Forschungsunterstützung, Nicht-US-amerikanische Gov't]. 2019 2019-04-01; 97(4):473-85.10.1007/s00109-018-01738-w
[4]. Yi X, Hu G, Yang Y, Li J, Jin J, Chang B. Rolle von MOTS-c bei der Regulation des Knochenstoffwechsels. FRONTPHYSIOL. [Fachartikel; Rezension]. 2023 2023-01-20; 14:1149120.10.3389/fphys.2023.1149120
[5]. D'Souza RF, Woodhead JST, Hedges CP, Zeng N, Wan J, Kumagai H, Lee C, Cohen P, Cameron-Smith D, Mitchell CJ, Merry TL. Eine erhöhte Expression des mitochondrial abgeleiteten Peptids MOTS-c in der Skelettmuskulatur gesunder alternder Männer ist mit der Myofaserzusammensetzung verbunden. Alterung (Albany, NY). [Fachartikel; Forschungsförderung, N.I.H., Extramural; Forschungsunterstützung, Nicht-US-amerikanische Gov't]. 2020 2020-03-17; 12(6):5244-58.10.18632/aging.102944
[6]. Mohtashami Z, Singh MK, Salimiaghdam N, Ozgul M, Kenney MC. MOTS-c, das jüngste mitochondrial abgeleitete Peptid bei alternden und altersbedingten Erkrankungen des Menschen. INT J MOL SCI. 2022; 23(19},ARTIKELNUMMER = {11991).10.3390/ijms231911991
[7]. Yu WD, Kim YJ, Cho MJ, Seok J, Kim GJ, Lee C, Ko JJ, Kim YS, Lee JH. Das mitochondrial abgeleitete Peptid MOTS-c fördert die Homöostase in gealterten, aus der menschlichen Plazenta abgeleiteten mesenchymalen Stammzellen in vitro MITOCHONDRION.[Fachartikel; Forschungsunterstützung, Nicht-US-amerikanische Gov't]. 20212021-05-01; 58:135-46.10.1016/j.mit o.2021.02.010
[8]. Yuan J, Wang M, Pan Y, Liang M, Fu Y, Duan Y, Tang M, Laher I, Li S. Das mitochondriale Signalpeptid MOTS-c verbessert die Myokardfunktion während des Trainings bei Ratten. SCI REP-UK. [Fachartikel; Forschungsunterstützung, Nicht-US-amerikanische Gov't]. 2021 2021-10-11; 11(1):20077.10.1038/s41598-021-99568-3
ALLE ARTIKEL UND PRODUKTINFORMATIONEN AUF DIESER WEBSITE DIENEN AUSSCHLIESSLICH ALS REFERENZ UND ZU BILDUNGSZWECKEN.
Die angebotenen Produkte sind streng für die In-vitro-Forschung vorgesehen (vom Latein: "in Glas"), was sich auf Studien außerhalb lebender Organismen bezieht. Diese Substanzen stellen keine pharmazeutischen Medikamente dar und wurden nicht von der US-amerikanischen Food and Drug Administration (FDA) zur Prävention, Behandlung oder Heilung von medizinischen Erkrankungen, Krankheiten oder Störungen geprüft oder zugelassen. Nach gesetzlichen Bestimmungen ist jegliche Einführung dieser Produkte in menschliche oder tierische biologische Systeme, unabhängig von der Verabreichungsmethode, ausdrücklich verboten.